Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Prior Fc receptor activation primes macrophages for increased sensitivity to IgG via long-term and short-term mechanisms
Developmental Cell ( IF 10.7 ) Pub Date : 2024-08-12 , DOI: 10.1016/j.devcel.2024.07.017 Annalise Bond 1 , Sareen Fiaz 1 , Kirstin Rollins 1 , Jazz Elaiza Q Nario 1 , Erika T Snyder 2 , Dixon J Atkins 2 , Samuel J Rosen 2 , Alyssa Granados 1 , Siddharth S Dey 3 , Maxwell Z Wilson 1 , Meghan A Morrissey 1
Developmental Cell ( IF 10.7 ) Pub Date : 2024-08-12 , DOI: 10.1016/j.devcel.2024.07.017 Annalise Bond 1 , Sareen Fiaz 1 , Kirstin Rollins 1 , Jazz Elaiza Q Nario 1 , Erika T Snyder 2 , Dixon J Atkins 2 , Samuel J Rosen 2 , Alyssa Granados 1 , Siddharth S Dey 3 , Maxwell Z Wilson 1 , Meghan A Morrissey 1
Affiliation
|
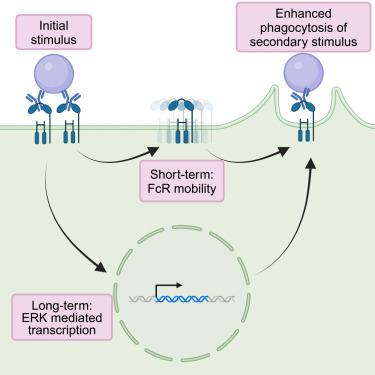
Macrophages measure the “eat-me” signal immunoglobulin G (IgG) to identify targets for phagocytosis. We tested whether prior encounters with IgG influence macrophage appetite. IgG is recognized by the Fc receptor. To temporally control Fc receptor activation, we engineered an Fc receptor that is activated by the light-induced oligomerization of Cry2, triggering phagocytosis. Using this tool, we demonstrate that subthreshold Fc receptor activation primes mouse bone-marrow-derived macrophages to be more sensitive to IgG in future encounters. Macrophages that have previously experienced subthreshold Fc receptor activation eat more IgG-bound human cancer cells. Increased phagocytosis occurs by two discrete mechanisms—a short- and long-term priming. Long-term priming requires new protein synthesis and Erk activity. Short-term priming does not require new protein synthesis and correlates with an increase in Fc receptor mobility. Our work demonstrates that IgG primes macrophages for increased phagocytosis, suggesting that therapeutic antibodies may become more effective after initial priming doses.
中文翻译:

先前的 Fc 受体激活通过长期和短期机制引发巨噬细胞对 IgG 的敏感性增加
巨噬细胞测量“eat-me”信号免疫球蛋白 G (IgG) 以识别吞噬作用的靶标。我们测试了先前与 IgG 的接触是否会影响巨噬细胞的食欲。IgG 被 Fc 受体识别。为了暂时控制 Fc 受体的激活,我们设计了一种 Fc 受体,该受体被光诱导的 Cry2 寡聚化激活,触发吞噬作用。使用该工具,我们证明亚阈值 Fc 受体激活使小鼠骨髓来源的巨噬细胞在未来的遭遇中对 IgG 更敏感。以前经历过亚阈值 Fc 受体激活的巨噬细胞会吃掉更多与 IgG 结合的人类癌细胞。吞噬作用增加是通过两种离散的机制发生的——短期和长期启动。长期引发需要新的蛋白质合成和 Erk 活性。短期启动不需要新的蛋白质合成,并且与 Fc 受体迁移率的增加相关。我们的工作表明,IgG 引发巨噬细胞以增加吞噬作用,这表明治疗性抗体在初始引发剂量后可能变得更加有效。
更新日期:2024-08-12
中文翻译:

先前的 Fc 受体激活通过长期和短期机制引发巨噬细胞对 IgG 的敏感性增加
巨噬细胞测量“eat-me”信号免疫球蛋白 G (IgG) 以识别吞噬作用的靶标。我们测试了先前与 IgG 的接触是否会影响巨噬细胞的食欲。IgG 被 Fc 受体识别。为了暂时控制 Fc 受体的激活,我们设计了一种 Fc 受体,该受体被光诱导的 Cry2 寡聚化激活,触发吞噬作用。使用该工具,我们证明亚阈值 Fc 受体激活使小鼠骨髓来源的巨噬细胞在未来的遭遇中对 IgG 更敏感。以前经历过亚阈值 Fc 受体激活的巨噬细胞会吃掉更多与 IgG 结合的人类癌细胞。吞噬作用增加是通过两种离散的机制发生的——短期和长期启动。长期引发需要新的蛋白质合成和 Erk 活性。短期启动不需要新的蛋白质合成,并且与 Fc 受体迁移率的增加相关。我们的工作表明,IgG 引发巨噬细胞以增加吞噬作用,这表明治疗性抗体在初始引发剂量后可能变得更加有效。































 京公网安备 11010802027423号
京公网安备 11010802027423号