当前位置:
X-MOL 学术
›
Mol. Microbiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
The dual role of a novel Sinorhizobium meliloti chemotaxis protein CheT in signal termination and adaptation
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-07-30 , DOI: 10.1111/mmi.15303 Alfred Agbekudzi 1 , Timofey D Arapov 1 , Ann M Stock 2 , Birgit E Scharf 1
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-07-30 , DOI: 10.1111/mmi.15303 Alfred Agbekudzi 1 , Timofey D Arapov 1 , Ann M Stock 2 , Birgit E Scharf 1
Affiliation
|
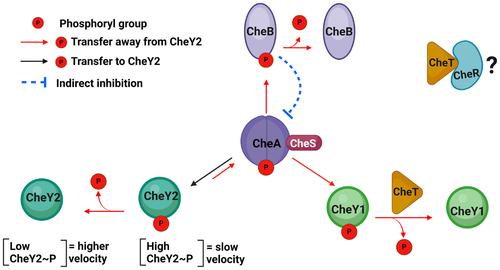
Sinorhizobium meliloti senses nutrients and compounds exuded from alfalfa host roots and coordinates an excitation, termination, and adaptation pathway during chemotaxis. We investigated the role of the novel S. meliloti chemotaxis protein CheT. While CheT and the Escherichia coli phosphatase CheZ share little sequence homology, CheT is predicted to possess an α-helix with a DXXXQ phosphatase motif. Phosphorylation assays demonstrated that CheT dephosphorylates the phosphate-sink response regulator, CheY1~P by enhancing its decay two-fold but does not affect the motor response regulator CheY2~P. Isothermal Titration Calorimetry (ITC) experiments revealed that CheT binds to a phosphomimic of CheY1~P with a KD of 2.9 μM, which is 25-fold stronger than its binding to CheY1. Dissimilar chemotaxis phenotypes of the ΔcheT mutant and cheT DXXXQ phosphatase mutants led to the hypothesis that CheT exerts additional function(s). A screen for potential binding partners of CheT revealed that it forms a complex with the methyltransferase CheR. ITC experiments confirmed CheT/CheR binding with a KD of 19 μM, and a SEC-MALS analysis determined a 1:1 and 2:1 CheT/CheR complex formation. Although they did not affect each other's enzymatic activity, CheT binding to CheY1~P and CheR may serve as a link between signal termination and sensory adaptation.
中文翻译:

新型 Sinorhizobium meliloti 趋化蛋白 CheT 在信号终止和适应中的双重作用
Sinorhizobium meliloti 感知紫花苜蓿寄主根系分泌的营养物质和化合物,并在趋化过程中协调激发、终止和适应途径。我们研究了新型 S. meliloti 趋化蛋白 CheT 的作用。虽然 CheT 和大肠杆菌磷酸酶 CheZ 的序列同源性很小,但预计 CheT 具有具有 DXXXQ 磷酸酶基序的α螺旋。磷酸化测定表明,CheT 通过使磷酸盐汇反应调节因子 CheY1~P 的衰变增加两倍来去磷酸化其,但不影响运动反应调节因子 CheY2~P。等温滴定量热法 (ITC) 实验显示,CheT 与 CheY1~P 的磷酸模拟物结合,KD 为 2.9 μM,比其与 CheY1 的结合强 25 倍。ΔcheT 突变体和 cheT DXXXQ 磷酸酶突变体的不同趋化性表型导致了 CheT 发挥额外功能的假设。对 CheT 潜在结合伴侣的筛选显示,它与甲基转移酶 CheR 形成复合物。ITC 实验证实 CheT/CheR 结合 KD 为 19 μM,SEC-MALS 分析确定了 1:1 和 2:1 的 CheT/CheR 复合物形成。虽然它们不影响彼此的酶活性,但 CheT 与 CheY1~P 和 CheR 的结合可能作为信号终止和感觉适应之间的联系。
更新日期:2024-07-30
中文翻译:

新型 Sinorhizobium meliloti 趋化蛋白 CheT 在信号终止和适应中的双重作用
Sinorhizobium meliloti 感知紫花苜蓿寄主根系分泌的营养物质和化合物,并在趋化过程中协调激发、终止和适应途径。我们研究了新型 S. meliloti 趋化蛋白 CheT 的作用。虽然 CheT 和大肠杆菌磷酸酶 CheZ 的序列同源性很小,但预计 CheT 具有具有 DXXXQ 磷酸酶基序的α螺旋。磷酸化测定表明,CheT 通过使磷酸盐汇反应调节因子 CheY1~P 的衰变增加两倍来去磷酸化其,但不影响运动反应调节因子 CheY2~P。等温滴定量热法 (ITC) 实验显示,CheT 与 CheY1~P 的磷酸模拟物结合,KD 为 2.9 μM,比其与 CheY1 的结合强 25 倍。ΔcheT 突变体和 cheT DXXXQ 磷酸酶突变体的不同趋化性表型导致了 CheT 发挥额外功能的假设。对 CheT 潜在结合伴侣的筛选显示,它与甲基转移酶 CheR 形成复合物。ITC 实验证实 CheT/CheR 结合 KD 为 19 μM,SEC-MALS 分析确定了 1:1 和 2:1 的 CheT/CheR 复合物形成。虽然它们不影响彼此的酶活性,但 CheT 与 CheY1~P 和 CheR 的结合可能作为信号终止和感觉适应之间的联系。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号