Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
将硫醇修饰的辣根过氧化物酶固定在金纳米颗粒上可增强酶稳定性并防止蛋白水解消化
Langmuir ( IF 3.7 ) Pub Date : 2024-06-26 , DOI: 10.1021/acs.langmuir.4c01180
Faith E Breausche 1 , Annelise Somerlot 1 , Jason Walder 1 , Kwame Osei 1 , Samuel Okyem 2 , Jeremy D Driskell 1
Affiliation
|
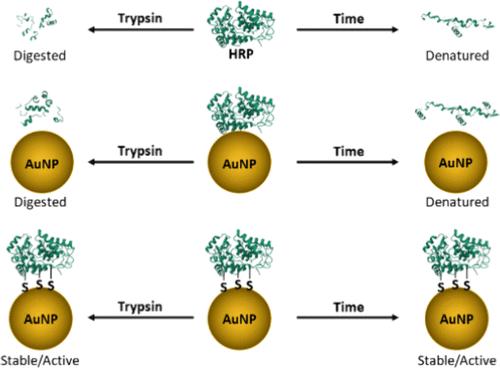
酶介导反应的特异性和效率有可能对许多生物技术产生积极影响;然而,许多酶很容易被降解。最近已经探索了在固体支持物上的固定化以提高酶的稳定性。本研究旨在获得见解并促进酶吸附到金纳米颗粒 (AuNP) 上,通过安装改变蛋白质化学性质的硫醇官能团形成稳定的生物缀合物。具体而言,模型酶辣根过氧化物酶 (HRP) 通过 Traut 试剂进行硫醇化,以提高生物结合物的稳健性和酶活性。本研究比较了 HRP 及其硫醇类似物 (THRP),以推断硫醇化和 AuNP 固定对酶活性和稳定性的影响。通过紫外可见分光光度法、圆二色性、zeta 电位和酶底物动力学测定法对 HRP、THRP 及其相应的生物结合物 HRP-AuNP 和 THRP-AuNP 进行了分析。我们的数据显示,与 HRP 相比,AuNP 对 THRP 的吸附增加了 5 倍,这意味着 THRP-AuNP 生物缀合物活性增加了 5 倍。相对于溶液中的天然酶,硫醇化和固定化的 HRP 在高温 (50 °C) 和储存时间 (1 个月) 下表现出稳定性的显着改善。此外,将 HRP、THRP 及其生物结合物与胰蛋白酶一起孵育,以评估对蛋白水解消化的敏感性。我们的结果表明,THRP-AuNP 生物缀合物在与胰蛋白酶孵育 18 小时后保持完整的酶活性,而游离 HRP、游离 THRP 和 HRP-AuNP 缀合物通过胰蛋白酶处理而失活。 这些结果凸显了蛋白质修饰和固定化在显着延长酶保质期、抵抗蛋白酶消化和增强生物功能以实现酶促生物技术方面的潜力。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号