当前位置:
X-MOL 学术
›
Environ. Microbiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Unveiling the role of novel carbohydrate‐binding modules in laminarin interaction of multimodular proteins from marine Bacteroidota during phytoplankton blooms
Environmental Microbiology ( IF 4.3 ) Pub Date : 2024-05-17 , DOI: 10.1111/1462-2920.16624 Marie-Katherin Zühlke 1, 2 , Elizabeth Ficko-Blean 3 , Daniel Bartosik 1, 2 , Nicolas Terrapon 4 , Alexandra Jeudy 3 , Murielle Jam 3 , Fengqing Wang 5 , Norma Welsch 1, 2 , Alexandra Dürwald 1, 6 , Laura Torres Martin 1 , Robert Larocque 3 , Diane Jouanneau 3 , Tom Eisenack 1 , François Thomas 3 , Anke Trautwein-Schult 7 , Hanno Teeling 5 , Dörte Becher 7 , Thomas Schweder 1, 2 , Mirjam Czjzek 3
Environmental Microbiology ( IF 4.3 ) Pub Date : 2024-05-17 , DOI: 10.1111/1462-2920.16624 Marie-Katherin Zühlke 1, 2 , Elizabeth Ficko-Blean 3 , Daniel Bartosik 1, 2 , Nicolas Terrapon 4 , Alexandra Jeudy 3 , Murielle Jam 3 , Fengqing Wang 5 , Norma Welsch 1, 2 , Alexandra Dürwald 1, 6 , Laura Torres Martin 1 , Robert Larocque 3 , Diane Jouanneau 3 , Tom Eisenack 1 , François Thomas 3 , Anke Trautwein-Schult 7 , Hanno Teeling 5 , Dörte Becher 7 , Thomas Schweder 1, 2 , Mirjam Czjzek 3
Affiliation
|
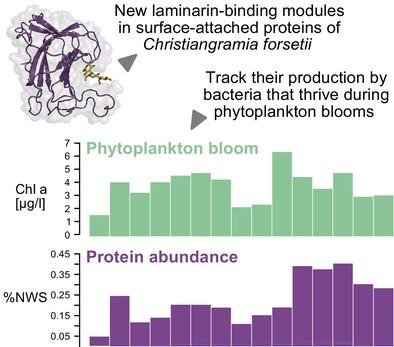
Laminarin, a β(1,3)‐glucan, serves as a storage polysaccharide in marine microalgae such as diatoms. Its abundance, water solubility and simple structure make it an appealing substrate for marine bacteria. Consequently, many marine bacteria have evolved strategies to scavenge and decompose laminarin, employing carbohydrate‐binding modules (CBMs) as crucial components. In this study, we characterized two previously unassigned domains as laminarin‐binding CBMs in multimodular proteins from the marine bacterium Christiangramia forsetii KT0803T , thereby introducing the new laminarin‐binding CBM families CBM102 and CBM103. We identified four CBM102s in a surface glycan‐binding protein (SGBP) and a single CBM103 linked to a glycoside hydrolase module from family 16 (GH16_3). Our analysis revealed that both modular proteins have an elongated shape, with GH16_3 exhibiting greater flexibility than SGBP. This flexibility may aid in the recognition and/or degradation of laminarin, while the constraints in SGBP could facilitate the docking of laminarin onto the bacterial surface. Exploration of bacterial metagenome‐assembled genomes (MAGs) from phytoplankton blooms in the North Sea showed that both laminarin‐binding CBM families are widespread among marine Bacteroidota . The high protein abundance of CBM102‐ and CBM103‐containing proteins during phytoplankton blooms further emphasizes their significance in marine laminarin utilization.
中文翻译:

揭示浮游植物繁殖过程中新型碳水化合物结合模块在海洋拟杆菌多模块蛋白与海带蛋白相互作用中的作用
海带多糖是一种 β(1,3)-葡聚糖,在硅藻等海洋微藻中充当储存多糖。它的丰富性、水溶性和简单的结构使其成为海洋细菌有吸引力的底物。因此,许多海洋细菌已经进化出清除和分解昆布多糖的策略,利用碳水化合物结合模块(CBM)作为关键组件。在这项研究中,我们将海洋细菌多模块蛋白中两个以前未指定的域作为昆布多糖结合 CBM 进行了表征福氏基督教藻KT0803时间,从而引入了新的昆布多糖结合 CBM 家族 CBM102 和 CBM103。我们在表面聚糖结合蛋白 (SGBP) 中鉴定出四个 CBM102,以及一个与家族 16 (GH16_3) 的糖苷水解酶模块相连的 CBM103。我们的分析表明,两种模块蛋白均具有细长的形状,其中 GH16_3 比 SGBP 表现出更大的灵活性。这种灵活性可能有助于昆布多糖的识别和/或降解,而 SGBP 的限制可以促进昆布多糖与细菌表面的对接。对北海浮游植物繁殖的细菌宏基因组组装基因组 (MAG) 的探索表明,两个昆布多糖结合 CBM 家族在海洋中广泛存在拟杆菌门。浮游植物繁殖过程中含有 CBM102 和 CBM103 的蛋白质的高丰度进一步强调了它们在海洋昆布多糖利用中的重要性。
更新日期:2024-05-17
中文翻译:

揭示浮游植物繁殖过程中新型碳水化合物结合模块在海洋拟杆菌多模块蛋白与海带蛋白相互作用中的作用
海带多糖是一种 β(1,3)-葡聚糖,在硅藻等海洋微藻中充当储存多糖。它的丰富性、水溶性和简单的结构使其成为海洋细菌有吸引力的底物。因此,许多海洋细菌已经进化出清除和分解昆布多糖的策略,利用碳水化合物结合模块(CBM)作为关键组件。在这项研究中,我们将海洋细菌多模块蛋白中两个以前未指定的域作为昆布多糖结合 CBM 进行了表征福氏基督教藻KT0803时间,从而引入了新的昆布多糖结合 CBM 家族 CBM102 和 CBM103。我们在表面聚糖结合蛋白 (SGBP) 中鉴定出四个 CBM102,以及一个与家族 16 (GH16_3) 的糖苷水解酶模块相连的 CBM103。我们的分析表明,两种模块蛋白均具有细长的形状,其中 GH16_3 比 SGBP 表现出更大的灵活性。这种灵活性可能有助于昆布多糖的识别和/或降解,而 SGBP 的限制可以促进昆布多糖与细菌表面的对接。对北海浮游植物繁殖的细菌宏基因组组装基因组 (MAG) 的探索表明,两个昆布多糖结合 CBM 家族在海洋中广泛存在拟杆菌门。浮游植物繁殖过程中含有 CBM102 和 CBM103 的蛋白质的高丰度进一步强调了它们在海洋昆布多糖利用中的重要性。































 京公网安备 11010802027423号
京公网安备 11010802027423号