当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
来自碱性磷酸酶超家族的磷酸单酯酶和磷酸二酯酶的比较酶学的机制和进化见解
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-10-20 , DOI: 10.1021/jacs.6b06186
Fanny Sunden 1 , Ishraq AlSadhan 1 , Artem Y. Lyubimov 2 , Susanne Ressl 3 , Helen Wiersma-Koch 1, 4 , Jamar Borland 1 , Clayton L. Brown 1 , Tory A. Johnson 1 , Zorawar Singh 1 , Daniel Herschlag 1, 5
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-10-20 , DOI: 10.1021/jacs.6b06186
Fanny Sunden 1 , Ishraq AlSadhan 1 , Artem Y. Lyubimov 2 , Susanne Ressl 3 , Helen Wiersma-Koch 1, 4 , Jamar Borland 1 , Clayton L. Brown 1 , Tory A. Johnson 1 , Zorawar Singh 1 , Daniel Herschlag 1, 5
Affiliation
|
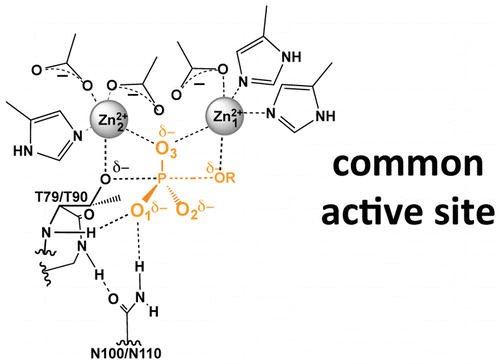
天真的人可能已经预料到碱性磷酸酶 (AP) 超家族的磷酸单酯酶和二酯酶之间的早期分裂。相反,先前的结果以及我们对来自脑膜败血杆菌的磷酸单酯酶 PafA 的结构和生化分析表明与超家族磷酸二酯酶 [柠檬黄单胞菌核苷酸焦磷酸酶/磷酸二酯酶 (NPP)] 的相似性以及与三种金属离子 AP 超家族单酯酶的明显差异, 来自大肠杆菌 AP (EcAP)。我们进行了一系列实验来绘制和学习这些酶之间的异同。首先,我们问为什么 AP 超家族中会有单酯酶的独立实例?相对于 EcAP,PafA 具有更弱的产物抑制和略高的活性,表明不同的代谢进化压力有利于不同的活性位点结构。接下来,我们分别讨论了 PafA 和 NPP 的优先磷酸单酯和二酯催化。我们询问了这些支架中 >80% 的序列差异是否为每种酶的同源反应提供了功能特化。与该模型的预期相反,PafA 和 NPP 突变体在每个天然支架中嵌入了共同的活性位点组子集,具有相同的单酯酶:二酯酶特异性;因此,天然特异性的 >107 倍差异似乎是由单个磷酰基取代基的不同相互作用引起的。我们还发现了 PafA 和 EcAP 单酯酶之间惊人的机制相似性,包括基态不稳定和功能性活性位点网络的证据,这些网络涉及不同的活性位点组,但可能发挥类似的催化作用。发现常见的网络功能可能会揭示对功能至关重要的活性位点结构连接,并且识别功能模块性区域可能有助于从现有的混杂模板中设计新的酶。更一般地说,比较酶学和催化滥交的分析可以提供机械和进化的见解。识别功能模块区域可能有助于从现有的混杂模板设计新酶。更一般地说,比较酶学和催化滥交的分析可以提供机械和进化的见解。识别功能模块区域可能有助于从现有的混杂模板设计新酶。更一般地说,比较酶学和催化滥交的分析可以提供机械和进化的见解。

"点击查看英文标题和摘要"
更新日期:2016-10-20

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号