当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Computational Design of an Unnatural Amino Acid Dependent Metalloprotein with Atomic Level Accuracy
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2013-08-29 , DOI: 10.1021/ja403503m Jeremy H Mills 1 , Sagar D Khare , Jill M Bolduc , Farhad Forouhar , Vikram Khipple Mulligan , Scott Lew , Jayaraman Seetharaman , Liang Tong , Barry L Stoddard , David Baker
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2013-08-29 , DOI: 10.1021/ja403503m Jeremy H Mills 1 , Sagar D Khare , Jill M Bolduc , Farhad Forouhar , Vikram Khipple Mulligan , Scott Lew , Jayaraman Seetharaman , Liang Tong , Barry L Stoddard , David Baker
Affiliation
|
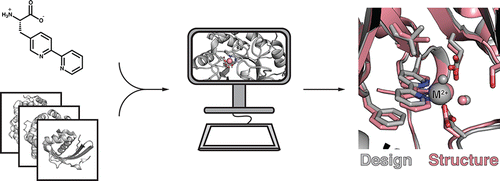
Genetically encoded unnatural amino acids could facilitate the design of proteins and enzymes of novel function, but correctly specifying sites of incorporation and the identities and orientations of surrounding residues represents a formidable challenge. Computational design methods have been used to identify optimal locations for functional sites in proteins and design the surrounding residues but have not incorporated unnatural amino acids in this process. We extended the Rosetta design methodology to design metalloproteins in which the amino acid (2,2'-bipyridin-5yl)alanine (Bpy-Ala) is a primary ligand of a bound metal ion. Following initial results that indicated the importance of buttressing the Bpy-Ala amino acid, we designed a buried metal binding site with octahedral coordination geometry consisting of Bpy-Ala, two protein-based metal ligands, and two metal-bound water molecules. Experimental characterization revealed a Bpy-Ala-mediated metalloprotein with the ability to bind divalent cations including Co(2+), Zn(2+), Fe(2+), and Ni(2+), with a Kd for Zn(2+) of ∼40 pM. X-ray crystal structures of the designed protein bound to Co(2+) and Ni(2+) have RMSDs to the design model of 0.9 and 1.0 Å respectively over all atoms in the binding site.
中文翻译:

具有原子级精度的非天然氨基酸依赖性金属蛋白的计算设计
遗传编码的非天然氨基酸可以促进具有新功能的蛋白质和酶的设计,但正确指定掺入位点以及周围残基的身份和方向是一项艰巨的挑战。计算设计方法已被用于确定蛋白质中功能位点的最佳位置并设计周围的残基,但并未在此过程中加入非天然氨基酸。我们扩展了 Rosetta 设计方法来设计金属蛋白,其中氨基酸 (2,2'-bipyridin-5yl) 丙氨酸 (Bpy-Ala) 是结合金属离子的主要配体。根据表明支持 Bpy-Ala 氨基酸重要性的初步结果,我们设计了一个埋藏的金属结合位点,具有八面体配位几何结构,由 Bpy-Ala、两个基于蛋白质的金属配体和两个金属结合的水分子。实验表征显示 Bpy-Ala 介导的金属蛋白具有结合二价阳离子的能力,包括 Co(2+)、Zn(2+)、Fe(2+) 和 Ni(2+),其 Kd 为 Zn(2+) +) ~ 40 pM。与 Co(2+) 和 Ni(2+) 结合的设计蛋白质的 X 射线晶体结构对结合位点中的所有原子的设计模型的均方根值分别为 0.9 和 1.0 Å。
更新日期:2013-08-29
中文翻译:

具有原子级精度的非天然氨基酸依赖性金属蛋白的计算设计
遗传编码的非天然氨基酸可以促进具有新功能的蛋白质和酶的设计,但正确指定掺入位点以及周围残基的身份和方向是一项艰巨的挑战。计算设计方法已被用于确定蛋白质中功能位点的最佳位置并设计周围的残基,但并未在此过程中加入非天然氨基酸。我们扩展了 Rosetta 设计方法来设计金属蛋白,其中氨基酸 (2,2'-bipyridin-5yl) 丙氨酸 (Bpy-Ala) 是结合金属离子的主要配体。根据表明支持 Bpy-Ala 氨基酸重要性的初步结果,我们设计了一个埋藏的金属结合位点,具有八面体配位几何结构,由 Bpy-Ala、两个基于蛋白质的金属配体和两个金属结合的水分子。实验表征显示 Bpy-Ala 介导的金属蛋白具有结合二价阳离子的能力,包括 Co(2+)、Zn(2+)、Fe(2+) 和 Ni(2+),其 Kd 为 Zn(2+) +) ~ 40 pM。与 Co(2+) 和 Ni(2+) 结合的设计蛋白质的 X 射线晶体结构对结合位点中的所有原子的设计模型的均方根值分别为 0.9 和 1.0 Å。

































 京公网安备 11010802027423号
京公网安备 11010802027423号