当前位置:
X-MOL 学术
›
Cell Calcium
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
特定 S100 蛋白对粒细胞-巨噬细胞集落刺激因子的识别
Cell Calcium ( IF 4.3 ) Pub Date : 2024-03-05 , DOI: 10.1016/j.ceca.2024.102869 Alexey S Kazakov 1 , Victoria A Rastrygina 1 , Alisa A Vologzhannikova 1 , Marina Y Zemskova 2 , Lolita A Bobrova 1 , Evgenia I Deryusheva 1 , Maria E Permyakova 1 , Andrey S Sokolov 1 , Ekaterina A Litus 1 , Marina P Shevelyova 1 , Vladimir N Uversky 3 , Eugene A Permyakov 1 , Sergei E Permyakov 1
Affiliation
|
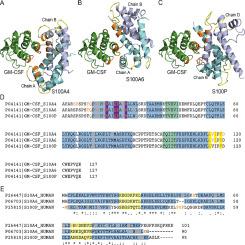
粒细胞巨噬细胞集落刺激因子(GM-CSF)是一种多效性骨髓生成生长因子和促炎细胞因子,临床上用于多种适应症,并作为治疗许多疾病的有希望的靶标,包括癌症、多发性硬化症、类风湿性关节炎、牛皮癣、哮喘、COVID-19。我们之前已经证明,多功能 S100 蛋白家族成员的 S100A6 和 S100P 蛋白的二聚 Ca 结合形式对 GM-CSF 具有特异性。为了探测这些相互作用的选择性,通过表面等离子共振光谱研究了重组人 GM-CSF 与 18 种重组人 S100 蛋白的二聚 Ca 负载形式的亲和力。其中,只有 S100A4 蛋白与 GM-CSF 特异性结合,平衡解离常数 为 0.3-2 μM,经内在荧光和化学交联数据证实。钙去除可防止 S100A4 与 GM-CSF 结合,而 S100A4/A6/P 蛋白的单体化会破坏 S100A4/A6 与 GM-CSF 的相互作用,并导致 S100P 对 GM-CSF 的亲和力略有下降。结构模型表明 GM-CSF 分子中存在保守的 S100A4/A6/P 结合位点,由其末端、螺旋 I 和 III 的残基组成,其中一些残基参与与 GM-CSF 受体的相互作用。通过诱变证实了 S100P 的“铰链”区和 F89 残基参与 GM-CSF 识别的预测。对 S100A4/A6/P 影响 GM-CSF 信号转导的能力的检查表明,S100A4/A6 抑制 GM-CSF 诱导的单核 THP-1 细胞活力的抑制。根据生物信息学分析,S100 蛋白调节 GM-CSF 活性的能力与各种肿瘤和其他疾病的进展相关。 在 GM-CSF 的临床使用和针对 GM-CSF 或其受体的治疗干预措施的开发中,应考虑细胞外形式的 S100 蛋白对 GM-CSF 信号传导的直接调节。

"点击查看英文标题和摘要"

















































 京公网安备 11010802027423号
京公网安备 11010802027423号