当前位置:
X-MOL 学术
›
Comput. Struct. Biotechnol. J.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
磷酸肽与酪氨酸磷酸酶 SHP2 的 N-SH2 结构域的结合与其中央 β 折叠的解压缩相关
Computational and Structural Biotechnology Journal ( IF 4.4 ) Pub Date : 2024-03-02 , DOI: 10.1016/j.csbj.2024.02.023
Michelangelo Marasco 1 , John Kirkpatrick 2 , Teresa Carlomagno 2, 3 , Jochen S Hub 4 , Massimiliano Anselmi 4
Affiliation
|
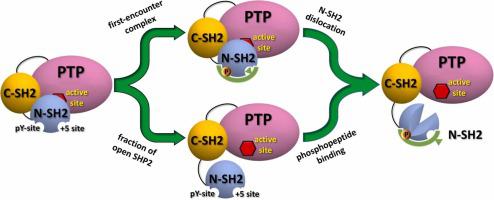
SHP2 是一种酪氨酸磷酸酶,在多个细胞内信号级联反应中起调节作用,并且已知在某些情况下具有致癌性。在没有效应子的情况下,SHP2 采用自身抑制构象,其 N-SH2 结构域阻断活性位点。鉴于 N-SH2 在调节 SHP2 中的关键作用,该结构域已被广泛研究,通常通过 X 射线晶体学进行。通过结合结构分析和分子动力学 (MD) 模拟,我们表明晶体学环境可以显着影响分离的 N-SH2 结构域的结构,从而导致误导性的解释。作为 X 射线晶体学的正交方法,我们结合使用 NMR 波谱和 MD 模拟来准确确定溶液中载脂蛋白 N-SH2 的构象。与基于晶体学数据的早期报告相比,我们的结果表明,溶液中的 apo N-SH2 主要采用具有完全压缩的中央 β 片的构象,并且该 β 片的部分解压缩是通过结合磷酸肽甚至磷酸盐/硫酸根离子来促进的。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号