Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Insight into the Effect of Submicellar Concentrations of Sodium Deoxycholate on the Structure, Stability, and Activity of Bovine and Human Serum Albumin: An Interesting Comparison between Single and Double Tryptophan Proteins
Langmuir ( IF 3.7 ) Pub Date : 2024-02-27 , DOI: 10.1021/acs.langmuir.3c03541 Subhrajit Mohanty 1 , Smruti Snigdha Mishra 1 , Kuldeep 1 , Jitendra Maharana 2 , Usharani Subuddhi 1
Langmuir ( IF 3.7 ) Pub Date : 2024-02-27 , DOI: 10.1021/acs.langmuir.3c03541 Subhrajit Mohanty 1 , Smruti Snigdha Mishra 1 , Kuldeep 1 , Jitendra Maharana 2 , Usharani Subuddhi 1
Affiliation
|
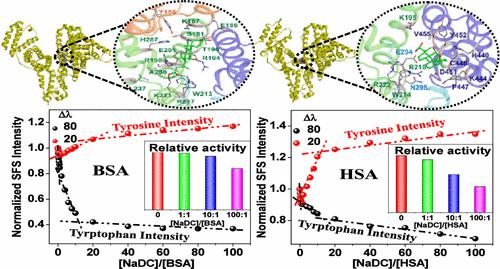
The progressive escalation in the applications of bile salts in diverse fields has triggered research on their interaction with various biological macromolecules, especially with proteins. A proper understanding of the interaction process of bile salts, particularly in the lower concentrations range, with the serum albumin seems important since the normal serum concentration of bile salts is approximately in the micromolar range. The current study deals with a comprehensive and comparative analysis of the interaction of submicellar concentrations of sodium deoxycholate (NaDC) with two homologous transport proteins: bovine serum albumin (BSA) and human serum albumin (HSA). HSA and BSA with one and two tryptophans, respectively, provide the opportunity for an interesting comparison of tryptophan fluorescence behavior on interaction with NaDC. The study suggests a sequential interaction of NaDC in three discrete stages with the two proteins. A detailed study using warfarin and ibuprofen as site markers provides information about the sites of interaction, which is further confirmed by inclusive molecular dynamics simulation analysis. Moreover, the comparison of the thermodynamics and stability of the NaDC–serum albumin complexes confirms the stronger interaction of NaDC with BSA as compared to that with HSA. The differential interaction between the bile salt and the two serum albumins is further established from the difference in the extent of decrease in the esterase-like activity assay of the proteins in the presence of NaDC. Therefore, the present study provides important insight into the effect of submicellar concentrations of NaDC on the structure, stability, and activity of the two homologous serum albumins and thus can contribute not only to the general understanding of the complex nature of serum albumin–bile salt interactions but also to the design of more effective pharmaceutical formulations in the field of drug delivery and biomedical research.
中文翻译:

深入了解亚胶束浓度的脱氧胆酸钠对牛和人血清白蛋白的结构、稳定性和活性的影响:单色氨酸和双色氨酸蛋白之间的有趣比较
胆汁盐在各个领域的应用不断升级,引发了对其与各种生物大分子,特别是蛋白质相互作用的研究。正确理解胆汁盐(特别是在较低浓度范围内)与血清白蛋白的相互作用过程似乎很重要,因为胆汁盐的正常血清浓度大约在微摩尔范围内。目前的研究对亚胶束浓度的脱氧胆酸钠 (NaDC) 与两种同源转运蛋白:牛血清白蛋白 (BSA) 和人血清白蛋白 (HSA) 的相互作用进行了全面的比较分析。 HSA 和 BSA 分别含有一种和两种色氨酸,为与 NaDC 相互作用时色氨酸荧光行为进行有趣的比较提供了机会。该研究表明 NaDC 在三个不同的阶段与这两种蛋白质发生连续相互作用。使用华法林和布洛芬作为位点标记的详细研究提供了有关相互作用位点的信息,并通过包容性分子动力学模拟分析进一步证实了这一点。此外,NaDC-血清白蛋白复合物的热力学和稳定性的比较证实了NaDC与BSA的相互作用比与HSA的相互作用更强。胆汁盐和两种血清白蛋白之间的不同相互作用是根据 NaDC 存在下蛋白质的酯酶样活性测定中降低程度的差异进一步确定的。 因此,本研究提供了关于亚胶束浓度的NaDC对两种同源血清白蛋白的结构、稳定性和活性的影响的重要见解,因此不仅有助于对血清白蛋白-胆汁盐的复杂性质的一般理解相互作用,还涉及药物输送和生物医学研究领域更有效的药物制剂的设计。
更新日期:2024-02-27
中文翻译:

深入了解亚胶束浓度的脱氧胆酸钠对牛和人血清白蛋白的结构、稳定性和活性的影响:单色氨酸和双色氨酸蛋白之间的有趣比较
胆汁盐在各个领域的应用不断升级,引发了对其与各种生物大分子,特别是蛋白质相互作用的研究。正确理解胆汁盐(特别是在较低浓度范围内)与血清白蛋白的相互作用过程似乎很重要,因为胆汁盐的正常血清浓度大约在微摩尔范围内。目前的研究对亚胶束浓度的脱氧胆酸钠 (NaDC) 与两种同源转运蛋白:牛血清白蛋白 (BSA) 和人血清白蛋白 (HSA) 的相互作用进行了全面的比较分析。 HSA 和 BSA 分别含有一种和两种色氨酸,为与 NaDC 相互作用时色氨酸荧光行为进行有趣的比较提供了机会。该研究表明 NaDC 在三个不同的阶段与这两种蛋白质发生连续相互作用。使用华法林和布洛芬作为位点标记的详细研究提供了有关相互作用位点的信息,并通过包容性分子动力学模拟分析进一步证实了这一点。此外,NaDC-血清白蛋白复合物的热力学和稳定性的比较证实了NaDC与BSA的相互作用比与HSA的相互作用更强。胆汁盐和两种血清白蛋白之间的不同相互作用是根据 NaDC 存在下蛋白质的酯酶样活性测定中降低程度的差异进一步确定的。 因此,本研究提供了关于亚胶束浓度的NaDC对两种同源血清白蛋白的结构、稳定性和活性的影响的重要见解,因此不仅有助于对血清白蛋白-胆汁盐的复杂性质的一般理解相互作用,还涉及药物输送和生物医学研究领域更有效的药物制剂的设计。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号