当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A General Method for Fluorescent Labeling of the N-Termini of Lanthipeptides and Its Application to Visualize their Cellular Localization
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2013-07-08 , DOI: 10.1021/ja4010706
Noah A Bindman 1 , Wilfred A van der Donk
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2013-07-08 , DOI: 10.1021/ja4010706
Noah A Bindman 1 , Wilfred A van der Donk
Affiliation
|
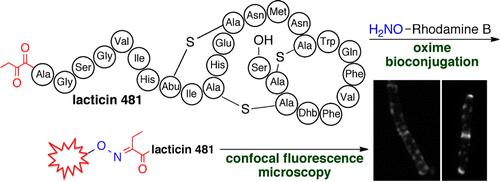
Labeling of natural products with biophysical probes has greatly contributed to investigations of their modes of action and has provided tools for visualization of their targets. A general challenge is the availability of a suitable functional group for chemoselective modification. We demonstrate here that an N-terminal ketone is readily introduced into various lanthipeptides by the generation of a cryptic N-terminal dehydro amino acid by the cognate biosynthetic enzymes. Spontaneous hydrolysis of the N-terminal enamines results in α-ketoamides that site-specifically react with an aminooxy-derivatized alkyne or fluorophore. The methodology was successfully applied to prochlorosins 1.7 and 2.8, as well as the lantibiotics lacticin 481, haloduracin α, and haloduracin β. The fluorescently modified lantibiotics were added to bacteria, and their cellular localization was visualized by confocal fluorescence microscopy. Lacticin 481 and haloduracin α localized predominantly at sites of new and old cell division as well as in punctate patterns along the long axis of rod-shaped bacilli, similar to the localization of lipid II. On the other hand, haloduracin β was localized nonspecifically in the absence of haloduracin α, but formed specific patterns when coadministered with haloduracin α. Using two-color labeling, colocalization of both components of the two-component lantibiotic haloduracin was demonstrated. These data with living cells supports a model in which the α component recognizes lipid II and then recruits the β-component.
中文翻译:

一种荧光标记羊毛肽N-末端的通用方法及其在细胞定位可视化中的应用
用生物物理探针对天然产物进行标记极大地促进了对其作用模式的研究,并为可视化其目标提供了工具。一个普遍的挑战是为化学选择性修饰提供合适的官能团。我们在此证明,通过同源生物合成酶产生神秘的 N 端脱氢氨基酸,很容易将 N 端酮引入各种羊毛肽中。N-末端烯胺的自发水解导致α-酮酰胺与氨基氧基衍生的炔烃或荧光团发生位点特异性反应。该方法成功地应用于prochlorosins 1.7 和2.8,以及羊毛硫抗生素lactin 481、haloduracin α 和haloduracin β。将荧光修饰的羊毛硫抗生素添加到细菌中,并通过共聚焦荧光显微镜观察它们的细胞定位。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。但与haloduracin α共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。但与haloduracin α共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。
更新日期:2013-07-08
中文翻译:

一种荧光标记羊毛肽N-末端的通用方法及其在细胞定位可视化中的应用
用生物物理探针对天然产物进行标记极大地促进了对其作用模式的研究,并为可视化其目标提供了工具。一个普遍的挑战是为化学选择性修饰提供合适的官能团。我们在此证明,通过同源生物合成酶产生神秘的 N 端脱氢氨基酸,很容易将 N 端酮引入各种羊毛肽中。N-末端烯胺的自发水解导致α-酮酰胺与氨基氧基衍生的炔烃或荧光团发生位点特异性反应。该方法成功地应用于prochlorosins 1.7 和2.8,以及羊毛硫抗生素lactin 481、haloduracin α 和haloduracin β。将荧光修饰的羊毛硫抗生素添加到细菌中,并通过共聚焦荧光显微镜观察它们的细胞定位。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。Lacticin 481 和 haloduracin α 主要定位于新旧细胞分裂部位以及棒状杆菌长轴上的点状图案,类似于脂质 II 的定位。另一方面,haloduracin β 在没有 haloduracin α 的情况下非特异性定位,但在与 haloduracin α 共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。但与haloduracin α共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。但与haloduracin α共同给药时形成特定模式。使用双色标记,证明了双组分羊毛硫抗生素的两种组分的共定位。这些活细胞数据支持一个模型,其中 α 成分识别脂质 II,然后招募 β 成分。





































 京公网安备 11010802027423号
京公网安备 11010802027423号