当前位置:
X-MOL 学术
›
Exp. Neurol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
BMSC-外泌体通过 mTOR/TFEB 轴恢复溶酶体功能,从而减轻 ALP 功能障碍,从而减少脑缺血再灌注损伤
Experimental Neurology ( IF 4.6 ) Pub Date : 2024-02-23 , DOI: 10.1016/j.expneurol.2024.114726
Haining Liu 1 , Chen Li 2 , Xiaofeng Zhang 1 , Hui Chen 1 , Qi Zhang 1 , Yuting Zeng 1 , Shuqi Zheng 1 , Jihua Zou 3 , Yijin Zhao 1 , Xiaoyan Zheng 4 , Guozhi Huang 1 , Qing Zeng 1
Affiliation
|
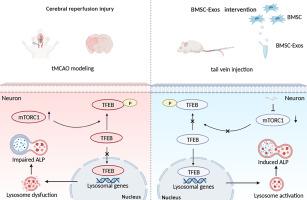
脑缺血再灌注损伤(CIRI)后复杂的病理生理变化包括缺陷蛋白质和受损细胞器的积累,从而导致大量神经元死亡。为了保持细胞稳态,自噬-溶酶体途径 (ALP) 对于神经元处理这些物质至关重要。许多研究表明,骨间充质干细胞外泌体(BMSC-Exos)可以降低CIRI。然而,其具体机制尚未得到很好的阐明,这限制了其广泛的临床应用。本研究旨在阐明 BMSC-Exos 是否可以通过抑制 mTOR 然后激活 TFEB 核易位来恢复 CIRI 后溶酶体功能,从而减轻 ALP 功能障碍。本研究通过流式细胞术、纳米粒子追踪分析(NTA)、透射电镜(TEM)、Western blot等方法鉴定本实验使用的BMSCs和BMSC-Exos符合要求。体内实验中,SD大鼠采用大脑中动脉暂时闭塞(tMCAO)造模,造模后2 h尾静脉注射BMSC-Exos。采用氯化三苯基四唑(TTC)染色、改良神经严重程度评分(mNSS)、转角试验和旋转棒试验检测BMSC-Exos干预后大鼠的神经功能缺损。采用Western blot和免疫荧光检测造模后和BMSC-Exos干预后不同时间点ALP、转录因子EB(TFEB)核转位以及哺乳动物雷帕霉素靶蛋白(mTOR)的变化。 体外实验中,对嗜铬细胞瘤细胞(PC12)细胞进行氧糖剥夺再灌注(OGD/R)建模,模拟CIRI,并分别用BMSC-Exos、BMSC-Exos + MHY 1485(mTOR激动剂)、雷帕霉素(mTOR 抑制剂)。采用CCK8、Western blot、免疫荧光检测PC12细胞存活、TFEB核转位、组织蛋白酶B(CTSB)免疫荧光强度。我们发现ALP功能障碍发生在tMCAO后72小时,BMSC-Exos可以通过恢复溶酶体功能来减轻ALP功能障碍。接下来,我们检查了 TFEB 核易位和易位关键调节因子 mTOR 的表达。我们发现BMSC-Exos可以抑制mTOR并激活TFEB核易位。其他体外测试表明,BMSC-Exos 可以增加 OGD/R 后 PC12 细胞的存活率,激活 TFEB 核易位并增强 CTSB 的荧光强度,而这反过来又可以被 mTOR 激动剂 MHY1485 逆转。这种效果与另一种 mTOR 抑制剂雷帕霉素类似。 BMSC-Exos 可以通过抑制 mTOR 然后促进 TFEB 核易位,恢复 CIRI 后的溶酶体功能,从而减轻 ALP 功能障碍。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号