当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
适用于蛋白质生物材料合成的祖先分选酶E的设计
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-02-20 , DOI: 10.1021/acscatal.4c00487
Azusa Miyata 1 , Taichi Chisuga 1 , Akira Kambe 1 , Ryo Miyata 1 , Yui Kawamura 1 , Hiroyuki Takeda 2 , Sohei Ito 1 , Shogo Nakano 1, 3
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-02-20 , DOI: 10.1021/acscatal.4c00487
Azusa Miyata 1 , Taichi Chisuga 1 , Akira Kambe 1 , Ryo Miyata 1 , Yui Kawamura 1 , Hiroyuki Takeda 2 , Sohei Ito 1 , Shogo Nakano 1, 3
Affiliation
|
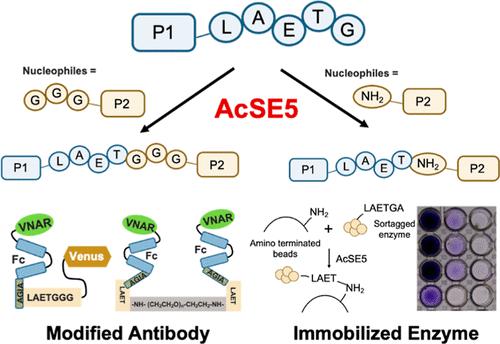
蛋白质生物材料将有潜力解决全球健康和环境挑战。存在多种生物材料的生产方法,其中分选酶介导的连接(SML)是代表性技术之一。SML 促进两种化合物的位点特异性缀合:C 末端具有细胞壁分选信号的供体肽或蛋白质,以及 N 末端具有寡甘氨酸的亲核体。在我们的研究中,我们通过序列数据挖掘和祖先序列重建相结合,重建了祖先分选酶E,命名为AcSE5。AcSE5 是一种独立于 Ca 2+ 的分选酶,可识别 C 末端带有 LAETG 的供体,并且可以使用 N 末端带有 GGG 或 GAA 的肽以及直链烷基胺作为亲核试剂。该酶可以实现高效的肽缀合,在最佳条件下超过70%。利用 AcSE5,我们合成了两种蛋白缀合物:金星缀合的鲨鱼可变新抗原受体 (VNAR) 和通过聚乙二醇二胺双缀合的 VNAR。使用 AcSE5 还实现了将酶直接固定到氨基封端的聚苯乙烯珠上。当与超热稳定的祖先l-氨基酸氧化酶(HTAncLAAO2)缀合时,所得珠子可用于将各种外消旋氨基酸去外消旋化成d-形式。对于三种苯丙氨酸衍生物,可以实现制备规模(100mg规模)的去消旋化。该工艺通过化学酶反应提供高对映纯度 (>99% ee ) 和分离产率 (>64%)。固定化的 HTAncLAAO2 对 10 次重复反应(总共 240 小时)表现出完全耐受性。AcSE5 是一种适用于 SML 应用的出色酶。

"点击查看英文标题和摘要"
更新日期:2024-02-20

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号