当前位置:
X-MOL 学术
›
Cell Chem. Bio.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Anti-tumor immunotherapy using engineered bacterial outer membrane vesicles fused to lysosome-targeting chimeras mediated by transferrin receptor
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2024-02-02 , DOI: 10.1016/j.chembiol.2024.01.002 Ling-Yan Su 1 , Yang Tian 1 , Qiang Zheng 2 , Yu Cao 2 , Mengyu Yao 2 , Shuangping Wang 3 , Wen Xu 3 , Chuyu Xi 3 , Andrea Clocchiatti 4 , Guangjun Nie 5 , Hejiang Zhou 1
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2024-02-02 , DOI: 10.1016/j.chembiol.2024.01.002 Ling-Yan Su 1 , Yang Tian 1 , Qiang Zheng 2 , Yu Cao 2 , Mengyu Yao 2 , Shuangping Wang 3 , Wen Xu 3 , Chuyu Xi 3 , Andrea Clocchiatti 4 , Guangjun Nie 5 , Hejiang Zhou 1
Affiliation
|
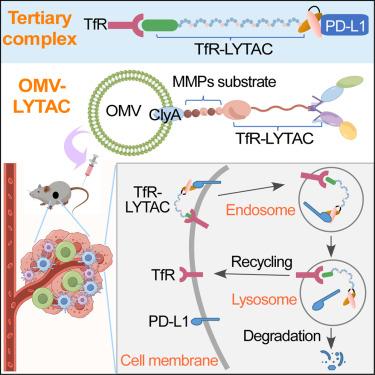
The lysosome-targeting chimera (LYTAC) approach has shown promise for the targeted degradation of secreted and membrane proteins via lysosomes. However, there have been challenges in design, development, and targeting. Here, we have designed a genetically engineered transferrin receptor (TfR)-mediated lysosome-targeting chimera (TfR-LYTAC) that is efficiently internalized via TfR-mediate endocytosis and targets PD-L1 for lysosomal degradation in cultured cells but not in vivo due to short half-life and poor tumor targeting. A delivery platform was developed by fusing TfR-LYTAC to the surface of bacterial outer membrane vesicles (OMVs). The engineered OMV-LYTAC combines PD-1/PD-L1 pathway inhibition with LYTAC and immune activation by bacterial OMVs. OMV-LYTAC significantly reduced tumor growth in vivo . We have provided a modular and simple genetic strategy for lysosomal degradation as well as a delivery platform for in vivo tumor targeting. The study paves the way for the targeting and degradation of extracellular proteins using the TfR-LYTAC system.
中文翻译:

使用工程细菌外膜囊泡与转铁蛋白受体介导的溶酶体靶向嵌合体融合的抗肿瘤免疫疗法
溶酶体靶向嵌合体 (LYTAC) 方法已显示出通过溶酶体靶向降解分泌蛋白和膜蛋白的前景。但是,在设计、开发和目标定位方面存在挑战。在这里,我们设计了一种基因工程转铁蛋白受体 (TfR) 介导的溶酶体靶向嵌合体 (TfR-LYTAC),它通过 TfR 介导的内吞作用有效内化,并靶向 PD-L1 在培养细胞中进行溶酶体降解,但由于半衰期短和肿瘤靶向性差,不在 体内降解。通过将 TfR-LYTAC 融合到细菌外膜囊泡 (OMV) 的表面,开发了一个递送平台。工程化的 OMV-LYTAC 将 PD-1/PD-L1 通路抑制与 LYTAC 以及细菌 OMV 的免疫激活相结合。OMV-LYTAC 显着降低体内肿瘤生长 。我们提供了一种模块化和简单的溶酶体降解遗传策略,以及用于体内肿瘤靶向的递送平台 。该研究为使用 TfR-LYTAC 系统靶向和降解细胞外蛋白铺平了道路。
更新日期:2024-02-02
中文翻译:

使用工程细菌外膜囊泡与转铁蛋白受体介导的溶酶体靶向嵌合体融合的抗肿瘤免疫疗法
溶酶体靶向嵌合体 (LYTAC) 方法已显示出通过溶酶体靶向降解分泌蛋白和膜蛋白的前景。但是,在设计、开发和目标定位方面存在挑战。在这里,我们设计了一种基因工程转铁蛋白受体 (TfR) 介导的溶酶体靶向嵌合体 (TfR-LYTAC),它通过 TfR 介导的内吞作用有效内化,并靶向 PD-L1 在培养细胞中进行溶酶体降解,但由于半衰期短和肿瘤靶向性差,不在 体内降解。通过将 TfR-LYTAC 融合到细菌外膜囊泡 (OMV) 的表面,开发了一个递送平台。工程化的 OMV-LYTAC 将 PD-1/PD-L1 通路抑制与 LYTAC 以及细菌 OMV 的免疫激活相结合。OMV-LYTAC 显着降低体内肿瘤生长 。我们提供了一种模块化和简单的溶酶体降解遗传策略,以及用于体内肿瘤靶向的递送平台 。该研究为使用 TfR-LYTAC 系统靶向和降解细胞外蛋白铺平了道路。

































 京公网安备 11010802027423号
京公网安备 11010802027423号