当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
解锁甲酸脱氢酶的催化多样性:NADPH 再生的甲酰胺活性和不对称还原胺化的胺供应
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-01-26 , DOI: 10.1021/acscatal.3c05409
Artur Maier 1 , Tanja Knaus 2 , Francesco G. Mutti 2 , Dirk Tischler 1
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-01-26 , DOI: 10.1021/acscatal.3c05409
Artur Maier 1 , Tanja Knaus 2 , Francesco G. Mutti 2 , Dirk Tischler 1
Affiliation
|
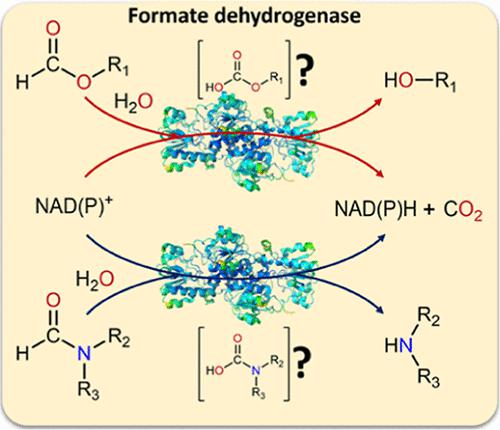
来自博伊丁假丝酵母的甲酸脱氢酶 (FDH)是一种经过充分研究和应用的酶,可用于各种反应中的 NADH 再生。由于许多氧化还原酶需要 NADPH,因此创建了 FDH 突变体,其辅因子特异性转向 NADP +。然而,在阐明氢化物供体的底物特异性方面所做的努力较少。在这里,我们报道了FDH催化甲酰胺(F)及其衍生物裂解成CO 2和胺,同时再生辅因子NADH和NADPH。野生型 FDH 和 NADP +接受变体 FDH C23S/D195Q/Y196R/Q197N (FDH M5) 在 10% (v/v) F, N-甲基甲酰胺 (MF) 和N , N-二甲基甲酰胺中显示出两种活性。分别为 80、67 和 4.5 mU/mg,以及 4.9、4.7 和 0.5 mU/mg。计算机对接和分子动力学模拟深入了解了底物结合,表明结合构象发生了改变。 NADP +接受变体被用于建立的级联中,通过米曲霉的还原胺酶以 MF 作为氢化物和胺供体对环己酮进行还原胺化,从而在全细胞方法中达到 72% 的转化率。这项工作拓宽了 FDH 在生物催化中的适用性。

"点击查看英文标题和摘要"
更新日期:2024-01-26

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号