当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过淀粉样前体蛋白的替代加工形成的淀粉样蛋白-α 肽通过交叉陪伴减弱阿尔茨海默氏症淀粉样蛋白-β 的毒性
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2024-01-18 , DOI: 10.1021/jacs.3c11511 Ariel J Kuhn 1 , Ka Chan 1 , Maria Sajimon 1 , Stan Yoo 2 , Vitor Hugo Balasco Serrão 3 , Jack Lee 1 , Benjamin Abrams 4 , James S Nowick 2 , Vladimir N Uversky 5 , Christopher Wheeler 6, 7, 8, 9, 10 , Jevgenij A Raskatov 1
Affiliation
|
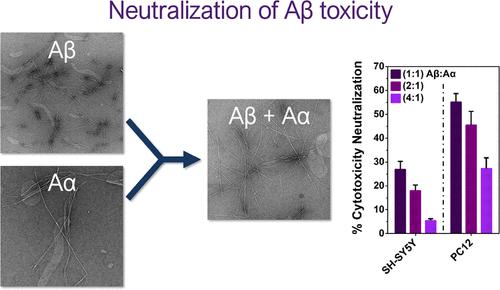
淀粉样蛋白聚集是阿尔茨海默病(AD)的一个关键特征,也是过去和现在治疗工作的主要目标。最近的研究越来越清楚地表明,为了成功的治疗,必须考虑淀粉样蛋白沉积物的异质性,其范围超出了通常靶向的淀粉样蛋白-β (Aβ)。我们最近证明,淀粉样蛋白-α(Aα 或 p3)是 Aβ 的 C 端肽片段,可以快速聚集形成淀粉样蛋白,并可以通过接种加速 Aβ 的聚集。在这里,我们通过几个重要的方式推进对 Aα 生物物理学和生物学的理解。我们首次报道了 Aα 淀粉样原纤维的低温电子显微镜 (cryo-EM) 结构,明确证明了该肽具有纤维化作用。我们证明 Aα 诱导 Aβ 形成淀粉样蛋白聚集体,其毒性比纯 Aβ 聚集体低,并使用核磁共振波谱 (NMR) 来深入了解溶液中 Aα 和 Aβ 之间的特定相互作用。这是 Aα 可以与 Aβ 共组装并在相对较低浓度下改变其生物效应的第一个证据。基于上述,我们敦促该领域的研究人员重新审视Aα在AD中的意义。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号