当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Amyloid Modifier SERF1a Accelerates Alzheimer’s Amyloid-β Fibrillization and Exacerbates the Cytotoxicity
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2024-01-11 , DOI: 10.1021/acschemneuro.3c00403
Tien-Ying Tsai, Wei-Ting Jhang, Hung-Kai Hsu, Yi-Tsu Chan, Chi-Fon Chang, Yun-Ru Chen
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2024-01-11 , DOI: 10.1021/acschemneuro.3c00403
Tien-Ying Tsai, Wei-Ting Jhang, Hung-Kai Hsu, Yi-Tsu Chan, Chi-Fon Chang, Yun-Ru Chen
|
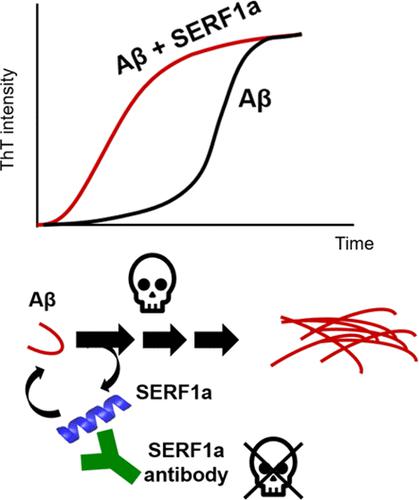
Alzheimer’s disease (AD) is a devastating, progressive neurodegenerative disease affecting the elderly in the world. The pathological hallmark senile plaques are mainly composed of amyloid-β (Aβ), in which the main isoforms are Aβ40 and Aβ42. Aβ is prone to aggregate and ultimately forms amyloid fibrils in the brains of AD patients. Factors that alter the Aβ aggregation process have been considered to be potential targets for treatments of AD. Modifier of aggregation 4 (MOAG-4)/small EDRK-rich factor (SERF) was previously selected from a chemical mutagenesis screen and identified as an amyloid modifier that promotes amyloid aggregation for α-synuclein, huntingtin, and Aβ40. The interaction and effect of yeast ScSERF on Aβ40 were previously described. Here, we examined the human SERF1a effect on Aβ40 and Aβ42 fibrillization by the Thioflavin T assay and found that SERF1a accelerated Aβ fibrillization in a dose-dependent manner without changing the fibril amount and without incorporation. By Fourier transform infrared spectroscopy (FTIR) and transmission electron microscopy (TEM), we found that SERF1a altered the secondary structures and the morphology of Aβ fibrils. The electrospray ionization mass spectrometry (ESI-MS) and analytical ultracentrifugation (AUC) results showed that SERF1a binds to Aβ in a 1:1 stoichiometry. Moreover, the NMR study showed that SERF1a interacts with Aβ via its N-terminal region. Cytotoxicity assay demonstrated that SERF1a enhanced toxicity of Aβ intermediates, and the effect can be rescued by SERF1a antibody. Overall, our study provides the underlying molecular mechanism for the SERF1a effect on Aβ fibrillization and facilitates the therapeutic development of AD.
中文翻译:

淀粉样蛋白修饰剂 SERF1a 加速阿尔茨海默病淀粉样蛋白-β 纤维化并加剧细胞毒性
阿尔茨海默病 (AD) 是一种破坏性、进行性神经退行性疾病,影响世界各地的老年人。老年斑的病理标志主要由β淀粉样蛋白(Aβ)组成,其中主要亚型为Aβ40和Aβ42。 Aβ 很容易聚集并最终在 AD 患者的大脑中形成淀粉样原纤维。改变 Aβ 聚集过程的因素被认为是 AD 治疗的潜在目标。聚集修饰剂 4 (MOAG-4)/小 EDRK 富集因子 (SERF) 先前从化学诱变筛选中选出,并被鉴定为淀粉样蛋白修饰剂,可促进 α-突触核蛋白、亨廷顿蛋白和 Aβ40 的淀粉样蛋白聚集。之前描述了酵母 ScSERF 对 Aβ40 的相互作用和影响。在这里,我们通过硫磺素 T 测定检查了人类 SERF1a 对 Aβ40 和 Aβ42 纤维化的影响,发现 SERF1a 以剂量依赖性方式加速 Aβ 纤维化,而不改变纤维量,也没有掺入。通过傅里叶变换红外光谱(FTIR)和透射电子显微镜(TEM),我们发现SERF1a改变了Aβ原纤维的二级结构和形态。电喷雾电离质谱 (ESI-MS) 和分析超速离心 (AUC) 结果表明 SERF1a 以 1:1 的化学计量与 Aβ 结合。此外,NMR 研究表明 SERF1a 通过其 N 末端区域与 Aβ 相互作用。细胞毒性试验表明SERF1a增强了Aβ中间体的毒性,并且SERF1a抗体可以挽救该效应。总的来说,我们的研究提供了 SERF1a 对 Aβ 纤维化作用的潜在分子机制,并促进 AD 治疗的发展。
更新日期:2024-01-11
中文翻译:

淀粉样蛋白修饰剂 SERF1a 加速阿尔茨海默病淀粉样蛋白-β 纤维化并加剧细胞毒性
阿尔茨海默病 (AD) 是一种破坏性、进行性神经退行性疾病,影响世界各地的老年人。老年斑的病理标志主要由β淀粉样蛋白(Aβ)组成,其中主要亚型为Aβ40和Aβ42。 Aβ 很容易聚集并最终在 AD 患者的大脑中形成淀粉样原纤维。改变 Aβ 聚集过程的因素被认为是 AD 治疗的潜在目标。聚集修饰剂 4 (MOAG-4)/小 EDRK 富集因子 (SERF) 先前从化学诱变筛选中选出,并被鉴定为淀粉样蛋白修饰剂,可促进 α-突触核蛋白、亨廷顿蛋白和 Aβ40 的淀粉样蛋白聚集。之前描述了酵母 ScSERF 对 Aβ40 的相互作用和影响。在这里,我们通过硫磺素 T 测定检查了人类 SERF1a 对 Aβ40 和 Aβ42 纤维化的影响,发现 SERF1a 以剂量依赖性方式加速 Aβ 纤维化,而不改变纤维量,也没有掺入。通过傅里叶变换红外光谱(FTIR)和透射电子显微镜(TEM),我们发现SERF1a改变了Aβ原纤维的二级结构和形态。电喷雾电离质谱 (ESI-MS) 和分析超速离心 (AUC) 结果表明 SERF1a 以 1:1 的化学计量与 Aβ 结合。此外,NMR 研究表明 SERF1a 通过其 N 末端区域与 Aβ 相互作用。细胞毒性试验表明SERF1a增强了Aβ中间体的毒性,并且SERF1a抗体可以挽救该效应。总的来说,我们的研究提供了 SERF1a 对 Aβ 纤维化作用的潜在分子机制,并促进 AD 治疗的发展。































 京公网安备 11010802027423号
京公网安备 11010802027423号