当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Targeted Protein Degradation through Recruitment of the CUL4 Complex Adaptor Protein DDB1
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2024-01-08 , DOI: 10.1021/acschembio.3c00487 Margot Meyers 1, 2, 3 , Sabine Cismoski 1, 2, 3 , Anoohya Panidapu 1, 2, 3 , Barbara Chie-Leon 2, 4 , Daniel K Nomura 1, 2, 3, 5
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2024-01-08 , DOI: 10.1021/acschembio.3c00487 Margot Meyers 1, 2, 3 , Sabine Cismoski 1, 2, 3 , Anoohya Panidapu 1, 2, 3 , Barbara Chie-Leon 2, 4 , Daniel K Nomura 1, 2, 3, 5
Affiliation
|
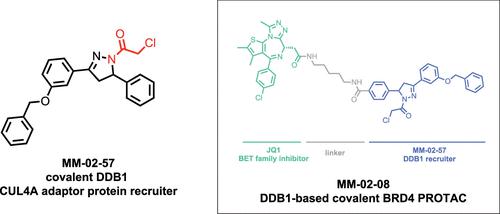
Targeted protein degradation has arisen as a powerful therapeutic modality for eliminating proteins. Thus far, most heterobifunctional proteolysis targeting chimeras (PROTACs) have utilized recruiters against substrate receptors of Cullin RING E3 ubiquitin ligases, such as cereblon and VHL. However, previous studies have surprisingly uncovered molecular glue degraders that exploit a CUL4 adaptor protein DDB1 to degrade neosubstrate proteins. Here, we sought to investigate whether DDB1 recruiters can be discovered that can be exploited for PROTAC applications. We utilized activity-based protein profiling and cysteine chemoproteomic screening to identify a covalent recruiter that targets C173 on DDB1 and exploited this recruiter to develop PROTACs against BRD4 and androgen receptor (AR). We demonstrated that the BRD4 PROTAC results in selective degradation of the short BRD4 isoform over the long isoform in a proteasome, NEDDylation, and DDB1-dependent manner. We also demonstrated degradation of AR with the AR PROTAC in prostate cancer cells. Our study demonstrated that covalent chemoproteomic approaches can be used to discover recruiters against Cullin RING adapter proteins and that these recruiters can be used for PROTAC applications to degrade neo-substrates.
中文翻译:

通过招募 CUL4 复合接头蛋白 DDB1 进行靶向蛋白质降解
靶向蛋白质降解已成为消除蛋白质的强大治疗方式。迄今为止,大多数异双功能蛋白水解靶向嵌合体 (PROTAC) 都利用了针对 Cullin RING E3 泛素连接酶底物受体的招募剂,例如 cereblon 和 VHL。然而,之前的研究令人惊讶地发现了分子胶降解剂,它们利用 CUL4 接头蛋白 DDB1 来降解新底物蛋白。在这里,我们试图调查是否可以发现可用于 PROTAC 应用的 DDB1 招募程序。我们利用基于活性的蛋白质分析和半胱氨酸化学蛋白质组学筛选来鉴定针对 DDB1 上的 C173 的共价招募子,并利用该招募子开发针对 BRD4 和雄激素受体 (AR) 的 PROTAC。我们证明,BRD4 PROTAC 导致短 BRD4 同工型以蛋白酶体、NEDDylation 和 DDB1 依赖的方式选择性降解长同工型。我们还证明了 AR PROTAC 在前列腺癌细胞中的降解作用。我们的研究表明,共价化学蛋白质组学方法可用于发现针对 Cullin RING 接头蛋白的招募剂,并且这些招募剂可用于 PROTAC 应用以降解新底物。
更新日期:2024-01-08
中文翻译:

通过招募 CUL4 复合接头蛋白 DDB1 进行靶向蛋白质降解
靶向蛋白质降解已成为消除蛋白质的强大治疗方式。迄今为止,大多数异双功能蛋白水解靶向嵌合体 (PROTAC) 都利用了针对 Cullin RING E3 泛素连接酶底物受体的招募剂,例如 cereblon 和 VHL。然而,之前的研究令人惊讶地发现了分子胶降解剂,它们利用 CUL4 接头蛋白 DDB1 来降解新底物蛋白。在这里,我们试图调查是否可以发现可用于 PROTAC 应用的 DDB1 招募程序。我们利用基于活性的蛋白质分析和半胱氨酸化学蛋白质组学筛选来鉴定针对 DDB1 上的 C173 的共价招募子,并利用该招募子开发针对 BRD4 和雄激素受体 (AR) 的 PROTAC。我们证明,BRD4 PROTAC 导致短 BRD4 同工型以蛋白酶体、NEDDylation 和 DDB1 依赖的方式选择性降解长同工型。我们还证明了 AR PROTAC 在前列腺癌细胞中的降解作用。我们的研究表明,共价化学蛋白质组学方法可用于发现针对 Cullin RING 接头蛋白的招募剂,并且这些招募剂可用于 PROTAC 应用以降解新底物。

































 京公网安备 11010802027423号
京公网安备 11010802027423号