当前位置:
X-MOL 学术
›
J. Med. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
新型结核分枝杆菌ClpP1P2抑制剂的发现及机理研究
Journal of Medicinal Chemistry ( IF 6.8 ) Pub Date : 2023-12-13 , DOI: 10.1021/acs.jmedchem.3c01054 Yang Yang 1, 2 , Ninglin Zhao 1 , Xin Xu 1 , Yuanzheng Zhou 1 , Baozhu Luo 1 , Jiangnan Zhang 1 , Jing Sui 1 , Jiasheng Huang 1 , Zhiqiang Qiu 1 , Xuelian Zhang 3 , Jumei Zeng 4 , Lang Bai 1 , Rui Bao 1 , Youfu Luo 1
Affiliation
|
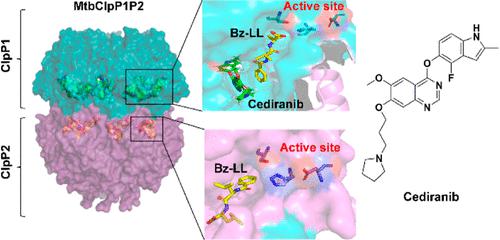
酪蛋白分解酶 P (ClpP) 负责对受损或错误折叠的蛋白质进行蛋白水解,在蛋白质组稳态中发挥着关键作用。 MtbClpP1P2是一种ClpP酶复合物,是结核分枝杆菌生存所必需的,因此被认为是开发抗结核药物的有希望的靶点。在这里,我们发现西地尼布及其一些衍生物是有效的 MtbClpP1P2 抑制剂,可抑制结核分枝杆菌的生长。蛋白质下拉和功能丧失测定验证了西地尼布及其活性衍生物对 MtbClpP1P2 的原位靶向。结构和突变研究表明,西地尼布通过与 MtbClpP1 亚基赤道柄结构域的变构袋结合而与 MtbClpP1P2 结合,与其他已知的 ClpP 调节剂相比,这代表了一种独特的结合模式。这些发现为我们提供了抗结核治疗合理药物设计的见解,并为我们理解 MtbClpP1P2 的生物活性提供了启示。

"点击查看英文标题和摘要"














































 京公网安备 11010802027423号
京公网安备 11010802027423号