当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
揭示同时靶向 EGFR 激酶上两个不同位点的双抑制剂的结构和结合见解
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2023-12-06 , DOI: 10.1021/acs.jpcb.3c04337 Kousik K Bhanja 1 , Madhur Sharma 1 , Niladri Patra 1
Affiliation
|
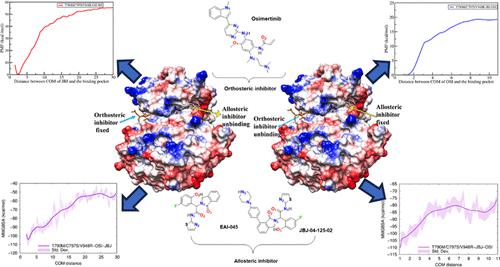
表皮生长因子受体 (EGFR) 是正常细胞中发现的第一个生长因子受体,与受体酪氨酸激酶相关,酪氨酸激酶可引起正常的细胞分裂。 EGFR 胞内激酶结构域的点突变迫使细胞随时间发生异常分裂,导致非小细胞肺癌 (NSCLC) 转化。因此,与 ATP 结合袋结合的竞争性抑制剂已被开发为 NSCLC 的靶向治疗。第三代激酶抑制剂奥希替尼目前在NSCLC的治疗中发挥着非常重要的作用。然而,它对C797S激酶结构域突变无效。因此,引入了第四代激酶非竞争性抑制剂,其通过与 ATP 结合区域附近的变构袋结合来发挥作用,并作为该突变激酶结构域的更好结合剂。然而,问题是这些单一的第四代激酶抑制剂可能不如单一药物有效。这项工作的目的是将这两种抑制剂的组合应用于 EGFR 的不同结合区域,而不重叠耐药机制,以获得它们之间发生的关键的直接和间接相互作用。此外,在固定在另一个结合位点的第二种抑制剂存在的情况下,抑制剂从其结合位点解离的自由能也是研究的重点。为了实现这一目标,我们进行了传统的分子动力学模拟和主成分分析以及动态互相关矩阵以及伞式采样。我们的结果表明,双重抑制剂的结合触发了蛋白质的构象变化,使其更接近非活性状态。 此外,在双重抑制剂存在的情况下,变构抑制剂与蛋白激酶EGFR的结合比正构抑制剂更强。最后,充分阐明了抑制剂的结合机制和解结合过程中重要的氢键残基。本研究深入了解了受体-正构抑制剂-变构抑制剂的结合,有助于进一步设计具有更好抑制作用的新型抑制剂。

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号