当前位置:
X-MOL 学术
›
J. Phys. Chem. Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
用实验和理论和频发生光谱观察空气-水界面α-突触核蛋白的伞状螺旋结构
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2023-12-04 , DOI: 10.1021/acs.jpclett.3c02543 Kris Strunge 1 , Tucker Burgin 2 , Thaddeus W Golbek 1 , Steven J Roeters 3 , Jim Pfaendtner 2 , Tobias Weidner 1, 2
Affiliation
|
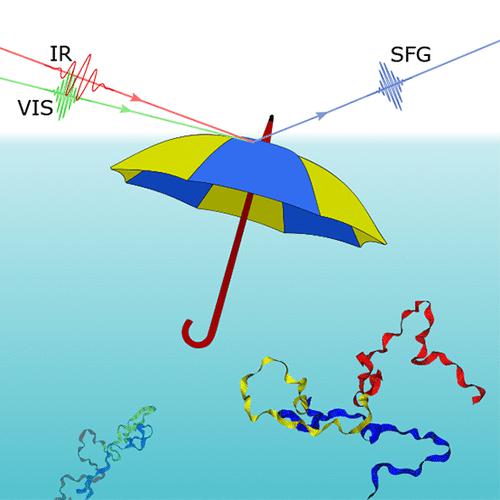
α-突触核蛋白 (αS) 错误折叠成淀粉样蛋白聚集体是由疏水性表面催化的,并且与严重的脑部疾病(例如帕金森病)相关。尽管界面起着重要作用,但界面处αS的三维结构仍不清楚。我们报告了单体αS与空气-水界面结合的界面特异性和频发生(SFG)实验,这是重要疏水表面的模型系统。我们将 SFG 光谱与基于分子动力学模拟的理论光谱计算相结合,表明 αS(溶液中本质上无序的蛋白质)在空气-水界面折叠成明确的、大部分为螺旋状的二级结构。结合姿势类似于伞形,其中 C 末端突出到水相中,而 N 末端和 NAC 区域跨越界面处的冠层。在这种结合姿势下,αS易于聚集,这可以解释疏水界面和气泡对αS原纤化的催化作用。

"点击查看英文标题和摘要"













































 京公网安备 11010802027423号
京公网安备 11010802027423号