当前位置:
X-MOL 学术
›
ACS Appl. Mater. Interfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Preclinical Assessment of Enhanced Chemodynamic Therapy by an FeMnOx-Based Nanocarrier: Tumor-Microenvironment-Mediated Fenton Reaction and ROS-Induced Chemotherapeutic for Boosted Antitumor Activity
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2023-11-28 , DOI: 10.1021/acsami.3c10733
Worku Batu Dirersa, Tzu-Chun Kan, Girum Getachew, Aswandi Wibrianto, Sonjid Ochirbat, Akash Rasal, Jungshan Chang, Jia-Yaw Chang
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2023-11-28 , DOI: 10.1021/acsami.3c10733
Worku Batu Dirersa, Tzu-Chun Kan, Girum Getachew, Aswandi Wibrianto, Sonjid Ochirbat, Akash Rasal, Jungshan Chang, Jia-Yaw Chang
|
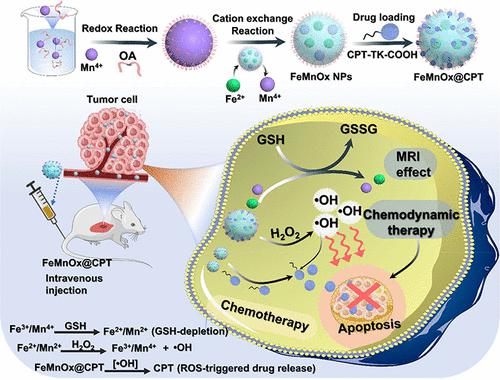
In recent studies, iron-containing Fenton nanocatalysts have demonstrated significant promise for clinical use due to their effective antitumor activity and low cytotoxicity. A new approach was reported in this work utilizing cation exchange synthesis to fabricate FeMnOx nanoparticles (NPs) that boost Fenton reactions and responses to the tumor microenvironment (TME) for chemodynamic therapy (CDT) and chemotherapy (CT). Within the TME, the redox metal pair of Fe2+/Mn2+ helps break down endogenous hydrogen peroxide (H2O2) into very harmful hydroxyl radicals (•OH) while simultaneously deactivating glutathione (GSH) to boost CDT performance. To further enhance the therapeutic potential, FeMnOx NPs were encapsulated with thioketal-linked camptothecin (CPT-TK-COOH), a reactive oxygen species (ROS)-responsive prodrug, achieving a high CPT-loading capacity of up to 51.1%. Upon ROS generation through the Fenton reaction, the prodrug TK linkage was disrupted, releasing 80% of the CPT payload within 48 h. Notably, FeMnOx@CPT exhibited excellent dual-modal imaging capabilities, enabling magnetic resonance and fluorescence imaging for image-guided therapy. In vitro studies showed the cytocompatibility of FeMnOx NPs using MDA-Mb-231 and 4T1 cells, but in the presence of H2O2, they induced significant cytotoxicity, resulting in 80% cell death through CDT and CT effects. Upon intravenous administration, FeMnOx@CPT displayed remarkable tumor accumulation, which enhanced tumor suppression in xenografts through improved CDT and CT effects. Moreover, no significant adverse effects were observed in the FeMnOx NP-treated animals. In the current study, the FeMnOx@CPT anticancer platform, with its boosted •OH-producing capability and ROS-cleavable drug release, has been validated utilizing in vitro and animal studies, suggesting its capacity as a viable strategy for clinical trials.
中文翻译:

基于 FeMnOx 的纳米载体增强化学动力学治疗的临床前评估:肿瘤微环境介导的芬顿反应和 ROS 诱导化疗以增强抗肿瘤活性
在最近的研究中,含铁芬顿纳米催化剂由于其有效的抗肿瘤活性和低细胞毒性而在临床应用中展现出巨大的前景。这项工作报告了一种利用阳离子交换合成来制造 FeMnO x纳米颗粒 (NP) 的新方法,该方法可增强芬顿反应和对肿瘤微环境 (TME) 的反应,用于化学动力学治疗 (CDT) 和化疗 (CT)。在 TME 中,氧化还原金属对 Fe 2+ /Mn 2+有助于将内源性过氧化氢 (H 2 O 2 ) 分解为非常有害的羟基自由基 (·OH),同时使谷胱甘肽 (GSH) 失活以提高 CDT 性能。为了进一步增强治疗潜力,FeMnO x NPs 被硫缩酮连接的喜树碱 (CPT-TK-COOH)(一种活性氧 (ROS) 响应性前药)封装,实现了高达 51.1% 的高 CPT 负载能力。通过 Fenton 反应生成 ROS 后,前药 TK 连接被破坏,在 48 小时内释放了 80% 的 CPT 有效负载。值得注意的是,FeMnO x @CPT 表现出出色的双模态成像能力,可为图像引导治疗提供磁共振和荧光成像。体外研究表明,FeMnO x NPs 使用 MDA-Mb-231 和 4T1 细胞具有细胞相容性,但在 H 2 O 2存在的情况下,它们会诱导显着的细胞毒性,通过 CDT 和 CT 效应导致 80% 的细胞死亡。静脉注射后,FeMnO x @CPT 显示出显着的肿瘤积累,通过改善 CDT 和 CT 效果增强异种移植物中的肿瘤抑制。 此外,在 FeMnO x NP 处理的动物中没有观察到明显的副作用。在当前的研究中,FeMnO x @CPT 抗癌平台具有增强的·OH 生成能力和 ROS 可裂解药物释放能力,已通过体外和动物研究得到验证,表明其作为临床试验的可行策略的能力。
更新日期:2023-11-28
中文翻译:

基于 FeMnOx 的纳米载体增强化学动力学治疗的临床前评估:肿瘤微环境介导的芬顿反应和 ROS 诱导化疗以增强抗肿瘤活性
在最近的研究中,含铁芬顿纳米催化剂由于其有效的抗肿瘤活性和低细胞毒性而在临床应用中展现出巨大的前景。这项工作报告了一种利用阳离子交换合成来制造 FeMnO x纳米颗粒 (NP) 的新方法,该方法可增强芬顿反应和对肿瘤微环境 (TME) 的反应,用于化学动力学治疗 (CDT) 和化疗 (CT)。在 TME 中,氧化还原金属对 Fe 2+ /Mn 2+有助于将内源性过氧化氢 (H 2 O 2 ) 分解为非常有害的羟基自由基 (·OH),同时使谷胱甘肽 (GSH) 失活以提高 CDT 性能。为了进一步增强治疗潜力,FeMnO x NPs 被硫缩酮连接的喜树碱 (CPT-TK-COOH)(一种活性氧 (ROS) 响应性前药)封装,实现了高达 51.1% 的高 CPT 负载能力。通过 Fenton 反应生成 ROS 后,前药 TK 连接被破坏,在 48 小时内释放了 80% 的 CPT 有效负载。值得注意的是,FeMnO x @CPT 表现出出色的双模态成像能力,可为图像引导治疗提供磁共振和荧光成像。体外研究表明,FeMnO x NPs 使用 MDA-Mb-231 和 4T1 细胞具有细胞相容性,但在 H 2 O 2存在的情况下,它们会诱导显着的细胞毒性,通过 CDT 和 CT 效应导致 80% 的细胞死亡。静脉注射后,FeMnO x @CPT 显示出显着的肿瘤积累,通过改善 CDT 和 CT 效果增强异种移植物中的肿瘤抑制。 此外,在 FeMnO x NP 处理的动物中没有观察到明显的副作用。在当前的研究中,FeMnO x @CPT 抗癌平台具有增强的·OH 生成能力和 ROS 可裂解药物释放能力,已通过体外和动物研究得到验证,表明其作为临床试验的可行策略的能力。































 京公网安备 11010802027423号
京公网安备 11010802027423号