当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
用于 ATP 结合蛋白全局分析的可点击光反应 ATP 亲和探针
Analytical Chemistry ( IF 6.7 ) Pub Date : 2023-11-22 , DOI: 10.1021/acs.analchem.3c02694 Zhiming Wang 1, 2 , Jing Tan 1, 2 , Mengxuan Li 1, 3 , Can Gao 1 , Wenwen Li 1, 3 , Jing Xu 1, 3 , Changchuan Guo 4 , Zhenzhen Chen 5 , Rong Cai 1, 2, 3
Affiliation
|
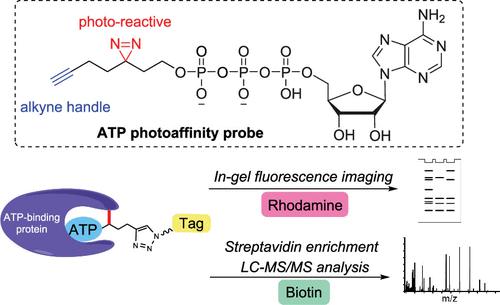
三磷酸腺苷(ATP)是生物体内主要的能量载体,有许多细胞蛋白可以与ATP结合。在这些蛋白质中,激酶是多种细胞信号传导过程的关键调节因子,异常的激酶信号传导导致许多人类疾病(包括癌症)的发生。因此,小分子激酶抑制剂已成功用于治疗多种疾病。由于许多激酶的 ATP 结合袋相似,因此评估不同激酶抑制剂的选择性非常重要。我们在这里报告了一种可点击的 ATP 光亲和探针,用于 ATP 结合蛋白的全局分析。将蛋白质裂解物与 ATP 探针一起孵育,然后进行紫外线 (UV) 照射,然后用炔烃手柄标记 ATP 结合蛋白,以便随后通过点击化学进行生物素缀合。标记的蛋白质用链霉亲和素珠富集,用胰蛋白酶消化,并使用液相色谱-串联质谱 (LC-MS/MS) 进行分析。超过 400 种 ATP 结合蛋白,包括大约 200 种激酶,可以在数据依赖采集模式下的单次 LC-MS/MS 运行中进行鉴定。然后,我们应用这种方法来分析三种选定的 ATP 竞争性激酶抑制剂的靶标。我们能够从无标记定量结果中成功识别出他们报告的一些靶蛋白,并使用蛋白质印迹分析验证结果。我们共同开发了一种可点击的 ATP 光亲和探针,用于 ATP 结合蛋白的蛋白质组范围分析,并证明这种化学蛋白质组方法适合激酶抑制剂的高通量靶标鉴定。

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号