当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Pif1 解旋酶通过促进 G-四链体 DNA 中的 Sub1 和富含 G 的单链 DNA 中的 Cdc13 解离来介导蛋白质-核酸复合物的重塑
Biochemistry ( IF 2.9 ) Pub Date : 2023-11-10 , DOI: 10.1021/acs.biochem.3c00441 Shubeena Chib 1 , Wezley C Griffin 1 , Jun Gao 1 , David R Proffitt 1 , Alicia K Byrd 1 , Kevin D Raney 1
Affiliation
|
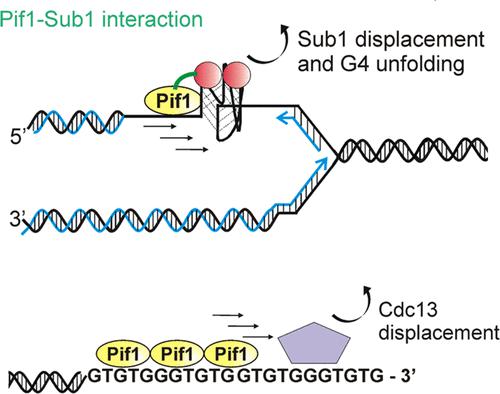
Pif1 是一种分子运动酶,从酵母到哺乳动物都是保守的。它在 ssDNA 上以方向偏倚(5' → 3')转位,并使用从 ATP 水解获得的能量展开双链体。Pif1 参与 dsDNA 断裂修复、G 四链体 (G4) 结构的分辨率、端粒的负调节和冈崎片段成熟。这种解旋酶的一个重要特性是施加力并破坏蛋白质-DNA 复合物,否则这些复合物可能会成为各种细胞通路的障碍。以前,据报道 Pif1 取代了生物素化 DNA 中的链霉亲和素、端粒 DNA 中的 Rap1 和 DNA 末端的端粒酶。在这里,我们研究了酿酒酵母 Pif1 解旋酶破坏 G4 和端粒位点蛋白质屏障的能力。酵母染色质相关转录共激活因子 Sub1 被表征为 G4 结合蛋白。我们发现了 Pif1 解旋酶和 Sub1 蛋白之间存在物理相互作用的证据。在这里,我们证明 Pif1 能够以 ATP 依赖性方式催化 Sub1 结合的 G4 结构的破坏。我们还研究了 Pif1 介导的酵母端粒加帽蛋白 Cdc13 从 DNA 末端的去除。Cdc13 与源自酵母端粒序列的 11-mer 表现出高亲和力相互作用。我们的结果表明,Pif1 利用其转位酶活性来增强这种端粒特异性蛋白与其结合位点的解离。解离速率随着解旋酶负载位点长度的增加而增加。此外,我们通过改变端粒 11-mer 在 5' 端和 3' 端的序列来研究 Pif1 催化蛋白置换的生化机制。结果支持一种模型,其中 Pif1 逐步破坏 ssDNA 中的 Cdc13。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号