当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
γ-分泌酶的分子动力学激活用于 Notch1 底物的切割
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2023-11-09 , DOI: 10.1021/acschemneuro.3c00594
Hung N Do , Shweta R Malvankar , Michael S Wolfe , Yinglong Miao
|
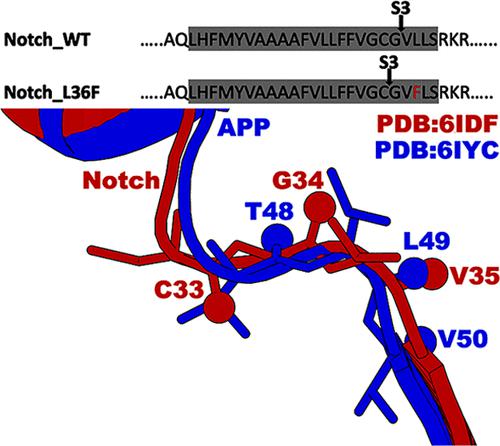
γ-分泌酶是一种膜内天冬氨酰蛋白酶复合物,通过早老素-1 (PS1) 催化亚基中的两个保守天冬氨酸 D257 和 D385 裂解 150 多种肽底物的跨膜结构域,包括淀粉样蛋白前体蛋白 (APP) 和 Notch 受体家族。然而,虽然 γ-分泌酶的激活对 APP 的切割已得到广泛研究,但 γ-分泌酶对 Notch 的切割仍然很少。在这里,我们将高斯加速分子动力学 (GaMD) 模拟和蛋白水解产物的质谱 (MS) 分析相结合,提出了第一个 γ-分泌酶切割 Notch 的动力学模型。MS 显示 γ-分泌酶在 Notch 残基 G34 处裂解 WT Notch,而 L36F 突变体 Notch 在 Notch 残基 C33 处发生裂解。最初,我们从 Notch 结合的 γ-分泌酶 (PDB: 6IDF) 的冷冻电镜结构开始准备模拟系统,但未能通过 γ-分泌酶捕获 WT 和 L36F Notch 的正确切割。然后,我们通过对齐 Notch 结合 (PDB: 6IDF) 和 APP 结合的 γ-分泌酶 (PDB: 6IYC) 的实验结构,发现 PS1 活性位点中 Notch 底物的注册不正确。APP 底物的每个残基都被系统地突变为相应的 Notch 残基,以制备 Notch 结合的 γ-分泌酶复合物的解析模型。解析模型的 GaMD 模拟成功捕获了 γ-分泌酶激活,以实现 WT 和 L36F 突变体 Notch 的正确切割。我们在这里介绍的研究结果为裂解 Notch 和其他底物所需的γ分泌酶激活所需的结构动力学和酶-底物相互作用提供了机制见解。

"点击查看英文标题和摘要"




































 京公网安备 11010802027423号
京公网安备 11010802027423号