当前位置:
X-MOL 学术
›
Int. J. Biol. Macromol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Aβ 和 tau 淀粉样蛋白核心肽共聚集的结构见解:通过模拟揭示潜在的病理性异寡聚体
International Journal of Biological Macromolecules ( IF 7.7 ) Pub Date : 2023-11-02 , DOI: 10.1016/j.ijbiomac.2023.127841 Xuhua Li 1 , Yujie Chen 2 , Zhiwei Yang 3 , Shengli Zhang 3 , Guanghong Wei 4 , Lei Zhang 3
Affiliation
|
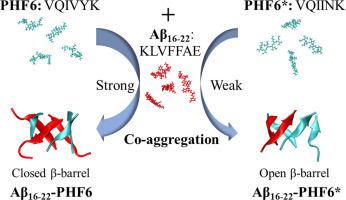
β 淀粉样蛋白 (Aβ) 和 tau 蛋白的自聚集与阿尔茨海默病 (AD) 密切相关。最近的证据表明,Aβ 和 tau 蛋白可以交叉相互作用形成共聚集体,从而加剧 AD 的发展。然而,它们的瞬时异低聚物构象和共聚集分子机制在很大程度上是未知的。在此,我们利用复制品交换分子动力学模拟来研究由 Aβ 的中央疏水核心 (Aβ 16-22 ) 和 tau 的两个原纤维成核核心片段 (PHF6* 和 PHF6) 中的每一个形成的构象整体。 PHF6 和 PHF6* 均被发现与 Aβ 16-22共聚集成富含 β-折叠的杂低聚物。有趣的是,PHF6 和 Aβ 16-22肽形成封闭的 β-桶,而 PHF6* 和 Aβ 16-22形成开放的 β-桶,这意味着它们具有独特的共聚集特性。与Aβ 16–22 -PHF6*相比,Aβ 16–22 -PHF6异低聚物具有更高的β-折叠含量,并且含有更长的β-链和更大的β-折叠,表明PHF6与Aβ 16-22的共聚集能力更强。进一步的分析表明,PHF6 的 Y310 和 Aβ 16-22之间的疏水性和 π-π 堆积相互作用对于 Aβ 16-22 -PHF6 异低聚物中闭合 β-桶/较大 β-折叠的形成至关重要。这些结果凸显了 PHF6 片段(特别是 Y310 残基)作为抑制 Aβ-tau 共聚集的潜在靶标的至关重要性,这有助于有效的治疗设计,以减轻 Aβ-tau 共聚集相关的淀粉样蛋白生成。

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号