当前位置:
X-MOL 学术
›
J. Biol. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
SLC3A2 N-糖基化和高尔基体重塑调节 SLC7A 氨基酸交换和应激缓解
Journal of Biological Chemistry ( IF 4.0 ) Pub Date : 2023-11-02 , DOI: 10.1016/j.jbc.2023.105416 Cunjie Zhang 1 , Massiullah Shafaq-Zadah 2 , Judy Pawling 1 , Geoffrey G Hesketh 1 , Estelle Dransart 2 , Karina Pacholczyk 1 , Joseph Longo 3 , Anne-Claude Gingras 4 , Linda Z Penn 3 , Ludger Johannes 2 , James W Dennis 5
Affiliation
|
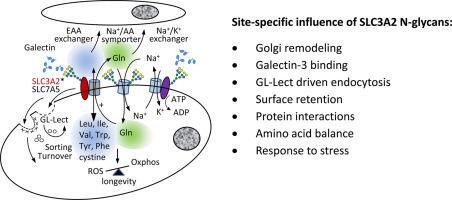
蛋白质稳态需要氧化代谢(ATP)和减轻谷胱甘肽造成的相关损伤,而随着衰老的关系日益失调。 SLC3A2 (4F2hc, CD98) 作为 SLC7A5 和 SLC7A11 交换器的二硫键连接接头发挥作用,分别输入必需氨基酸和胱氨酸,同时输出 Gln 和 Glu。 SLC3A2 上 N-糖基化位点的位置随着灵长类动物的出现而进化,大概与新陈代谢同步。在此,我们报告 SLC3A2 的四个位点中的每一个都具有不同的高尔基体修饰 N-聚糖特征。灵长类衍生位点 N381 处的 N-聚糖稳定了半乳糖凝集素 3 晶格中的 SLC3A2,以抵抗包被凹坑内吞作用,而最接近膜的位点 N365 则促进糖脂半乳糖凝集素 3 (GL-Lect) 驱动的内吞作用。我们的结果表明,表面保留和内吞作用通过 SLC3A2 上 N-聚糖的数量、位置和重塑精确平衡。此外,蛋白质组学和功能分析揭示了 SLC3A2*SLC7A5 异二聚体与氨基酸/Na 同向转运体(SLC1A4、SLC1A5)的 N-聚糖依赖性聚类,平衡支链氨基酸和 Gln 水平,但以 ATP 为代价来维持Na/K 梯度。在充足的条件下,SLC3A2 相互作用需要 N365D 和 N381D 处的高尔基体修饰的 N-聚糖,而通过氟伐他汀治疗减少内质网中的 N-糖基化促进了缓解应激所需的 CD44 和转运蛋白的募集。因此,SLC3A2 N-糖基化和 N-聚糖的高尔基体重塑在生长、维持和代谢应激的氨基酸输入中具有独特的作用。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号