当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
机器学习本质无序蛋白质磷酸化导致的微妙构象变化
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2023-10-31 , DOI: 10.1021/acs.jpcb.3c05136
Subinoy Adhikari 1 , Jagannath Mondal 1
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2023-10-31 , DOI: 10.1021/acs.jpcb.3c05136
Subinoy Adhikari 1 , Jagannath Mondal 1
Affiliation
|
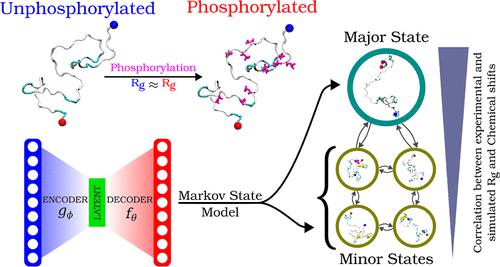
本质无序蛋白质/区域 (IDP/IDR) 的磷酸化对细胞信号传导、蛋白质折叠或解折叠以及长程变构效应等生物功能具有深远影响。然而,这里我们重点关注两个 IDP,即酿酒酵母中发现的 83 残基 IDR 转录因子 Ash1 和 CDK 抑制剂 Sic1 蛋白的 92 残基长 N 端区域,其平均构象特性的实验测量,即半径旋转和结构因子表明磷酸化后的变化可以忽略不计。在这里,我们表明,通过结合无监督机器学习和广泛的分子动力学(MD)轨迹对构象整体进行明智的剖析可以突出磷酸化和野生型IDP之间的关键差异和相似之处。特别是,我们使用自动编码器的潜在空间维度开发马尔可夫状态模型(MSM),并使用多微秒长的 MD 模拟轨迹进行训练。对磷酸化之前和之后状态之间的结构变化进行检查,捕获了它们的主链接触图、二级结构和扭转角的一些相似之处和差异。氢键分析表明,磷酸化不仅增加了氢键的数量,而且还改变了主链和侧链原子与磷酸化残基之间的氢键模式。我们还观察到,虽然磷酸化引入了盐桥,但阳离子-π相互作用消失了。磷酸化还提高了长距离疏水接触的可能性,还增强了与水分子的相互作用,并改善了水的局部结构,从几何顺序参数可以明显看出。对这些机器学习状态的观察提供了重要的见解,因为如果我们要了解 IDP 磷酸化在其生物学功能中的作用,就很难通过实验确定哪个是重要的。

"点击查看英文标题和摘要"
更新日期:2023-10-31

"点击查看英文标题和摘要"





































 京公网安备 11010802027423号
京公网安备 11010802027423号