当前位置:
X-MOL 学术
›
Acc. Chem. Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Integrative Approach to Probe Alternative Redox Mechanisms in RNA Modifications
Accounts of Chemical Research ( IF 16.4 ) Pub Date : 2023-11-02 , DOI: 10.1021/acs.accounts.3c00418 Charles Bou-Nader 1 , Ludovic Pecqueur 1 , Valérie de Crécy-Lagard 2, 3 , Djemel Hamdane 1
Accounts of Chemical Research ( IF 16.4 ) Pub Date : 2023-11-02 , DOI: 10.1021/acs.accounts.3c00418 Charles Bou-Nader 1 , Ludovic Pecqueur 1 , Valérie de Crécy-Lagard 2, 3 , Djemel Hamdane 1
Affiliation
|
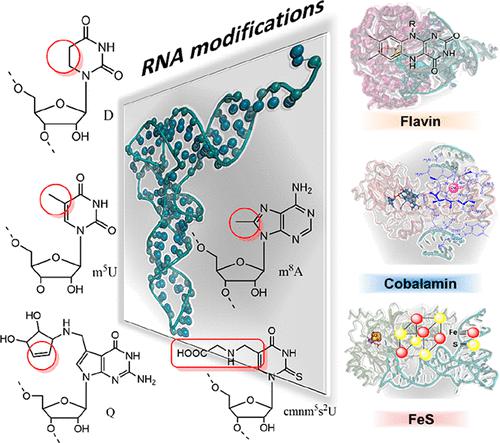
RNA modifications found in most RNAs, particularly in tRNAs and rRNAs, reveal an abundance of chemical alterations of nucleotides. Over 150 distinct RNA modifications are known, emphasizing a remarkable diversity of chemical moieties in RNA molecules. These modifications play pivotal roles in RNA maturation, structural integrity, and the fidelity and efficiency of translation processes. The catalysts responsible for these modifications are RNA-modifying enzymes that use a striking array of chemistries to directly influence the chemical landscape of RNA. This diversity is further underscored by instances where the same modification is introduced by distinct enzymes that use unique catalytic mechanisms and cofactors across different domains of life. This phenomenon of convergent evolution highlights the biological importance of RNA modification and the vast potential within the chemical repertoire for nucleotide alteration. While shared RNA modifications can hint at conserved enzymatic pathways, a major bottleneck is to identify alternative routes within species that possess a modified RNA but are devoid of known RNA-modifying enzymes. To address this challenge, a combination of bioinformatic and experimental strategies proves invaluable in pinpointing new genes responsible for RNA modifications. This integrative approach not only unveils new chemical insights but also serves as a wellspring of inspiration for biocatalytic applications and drug design. In this Account, we present how comparative genomics and genome mining, combined with biomimetic synthetic chemistry, biochemistry, and anaerobic crystallography, can be judiciously implemented to address unprecedented and alternative chemical mechanisms in the world of RNA modification. We illustrate these integrative methodologies through the study of tRNA and rRNA modifications, dihydrouridine, 5-methyluridine, queuosine, 8-methyladenosine, 5-carboxymethylamino-methyluridine, or 5-taurinomethyluridine, each dependent on a diverse array of redox chemistries, often involving organic compounds, organometallic complexes, and metal coenzymes. We explore how vast genome and tRNA databases empower comparative genomic analyses and enable the identification of novel genes that govern RNA modification. Subsequently, we describe how the isolation of a stable reaction intermediate can guide the synthesis of a biomimetic to unveil new enzymatic pathways. We then discuss the usefulness of a biochemical “shunt” strategy to study catalytic mechanisms and to directly visualize reactive intermediates bound within active sites. While we primarily focus on various RNA-modifying enzymes studied in our laboratory, with a particular emphasis on the discovery of a SAM-independent methylation mechanism, the strategies and rationale presented herein are broadly applicable for the identification of new enzymes and the elucidation of their intricate chemistries. This Account offers a comprehensive glimpse into the evolving landscape of RNA modification research and highlights the pivotal role of integrated approaches to identify novel enzymatic pathways.
中文翻译:

探测 RNA 修饰中替代氧化还原机制的综合方法
大多数 RNA(尤其是 tRNA 和 rRNA)中发现的 RNA 修饰揭示了丰富的核苷酸化学变化。已知超过 150 种不同的 RNA 修饰,强调了 RNA 分子中化学部分的显着多样性。这些修饰在 RNA 成熟、结构完整性以及翻译过程的保真度和效率中发挥着关键作用。负责这些修饰的催化剂是 RNA 修饰酶,它们使用一系列惊人的化学物质来直接影响 RNA 的化学景观。这种多样性通过不同的酶引入相同的修饰而得到进一步强调,这些酶在不同的生命领域使用独特的催化机制和辅助因子。这种趋同进化的现象凸显了 RNA 修饰的生物学重要性以及核苷酸改变化学库中的巨大潜力。虽然共享的 RNA 修饰可以暗示保守的酶途径,但一个主要的瓶颈是在拥有修饰的 RNA 但缺乏已知的 RNA 修饰酶的物种内识别替代途径。为了应对这一挑战,生物信息学和实验策略的结合在查明负责 RNA 修饰的新基因方面被证明是非常有价值的。这种综合方法不仅揭示了新的化学见解,而且还为生物催化应用和药物设计提供了灵感的源泉。在这篇文章中,我们介绍了如何明智地实施比较基因组学和基因组挖掘,与仿生合成化学、生物化学和厌氧晶体学相结合,以解决 RNA 修饰领域前所未有的替代化学机制。 我们通过研究 tRNA 和 rRNA 修饰、二氢尿苷、5-甲基尿苷、queuosine、8-甲基腺苷、5-羧甲基氨基-甲基尿苷或 5-牛磺酸甲基尿苷来说明这些综合方法,每种修饰都依赖于多种氧化还原化学反应,通常涉及有机反应。化合物、有机金属络合物和金属辅酶。我们探索庞大的基因组和 tRNA 数据库如何支持比较基因组分析并识别控制 RNA 修饰的新基因。随后,我们描述了稳定反应中间体的分离如何指导仿生剂的合成以揭示新的酶促途径。然后,我们讨论生化“分流”策略在研究催化机制和直接可视化活性位点内结合的反应中间体方面的有用性。虽然我们主要关注我们实验室研究的各种 RNA 修饰酶,特别强调独立于 SAM 的甲基化机制的发现,但本文提出的策略和基本原理广泛适用于新酶的鉴定及其阐明复杂的化学反应。本报告全面介绍了 RNA 修饰研究的发展前景,并强调了综合方法在识别新酶途径方面的关键作用。
更新日期:2023-11-02
中文翻译:

探测 RNA 修饰中替代氧化还原机制的综合方法
大多数 RNA(尤其是 tRNA 和 rRNA)中发现的 RNA 修饰揭示了丰富的核苷酸化学变化。已知超过 150 种不同的 RNA 修饰,强调了 RNA 分子中化学部分的显着多样性。这些修饰在 RNA 成熟、结构完整性以及翻译过程的保真度和效率中发挥着关键作用。负责这些修饰的催化剂是 RNA 修饰酶,它们使用一系列惊人的化学物质来直接影响 RNA 的化学景观。这种多样性通过不同的酶引入相同的修饰而得到进一步强调,这些酶在不同的生命领域使用独特的催化机制和辅助因子。这种趋同进化的现象凸显了 RNA 修饰的生物学重要性以及核苷酸改变化学库中的巨大潜力。虽然共享的 RNA 修饰可以暗示保守的酶途径,但一个主要的瓶颈是在拥有修饰的 RNA 但缺乏已知的 RNA 修饰酶的物种内识别替代途径。为了应对这一挑战,生物信息学和实验策略的结合在查明负责 RNA 修饰的新基因方面被证明是非常有价值的。这种综合方法不仅揭示了新的化学见解,而且还为生物催化应用和药物设计提供了灵感的源泉。在这篇文章中,我们介绍了如何明智地实施比较基因组学和基因组挖掘,与仿生合成化学、生物化学和厌氧晶体学相结合,以解决 RNA 修饰领域前所未有的替代化学机制。 我们通过研究 tRNA 和 rRNA 修饰、二氢尿苷、5-甲基尿苷、queuosine、8-甲基腺苷、5-羧甲基氨基-甲基尿苷或 5-牛磺酸甲基尿苷来说明这些综合方法,每种修饰都依赖于多种氧化还原化学反应,通常涉及有机反应。化合物、有机金属络合物和金属辅酶。我们探索庞大的基因组和 tRNA 数据库如何支持比较基因组分析并识别控制 RNA 修饰的新基因。随后,我们描述了稳定反应中间体的分离如何指导仿生剂的合成以揭示新的酶促途径。然后,我们讨论生化“分流”策略在研究催化机制和直接可视化活性位点内结合的反应中间体方面的有用性。虽然我们主要关注我们实验室研究的各种 RNA 修饰酶,特别强调独立于 SAM 的甲基化机制的发现,但本文提出的策略和基本原理广泛适用于新酶的鉴定及其阐明复杂的化学反应。本报告全面介绍了 RNA 修饰研究的发展前景,并强调了综合方法在识别新酶途径方面的关键作用。















































 京公网安备 11010802027423号
京公网安备 11010802027423号