当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Internal Fragment Ions from Higher Energy Collision Dissociation Enable the Glycoform-Resolved Asn325 Deamidation Assessment of Antibodies by Middle-Down Mass Spectrometry
Analytical Chemistry ( IF 6.7 ) Pub Date : 2023-10-30 , DOI: 10.1021/acs.analchem.3c03015 Steffen Lippold 1 , Lance Cadang 1 , Tilman Schlothauer 2 , Feng Yang 1
Analytical Chemistry ( IF 6.7 ) Pub Date : 2023-10-30 , DOI: 10.1021/acs.analchem.3c03015 Steffen Lippold 1 , Lance Cadang 1 , Tilman Schlothauer 2 , Feng Yang 1
Affiliation
|
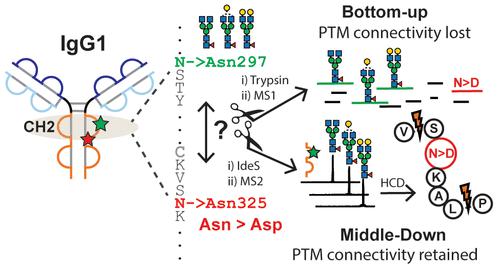
A major challenge in proteoform characterization is to obtain information on coexisting post-translational modifications (PTMs), which is lost in traditional bottom-up analysis. Middle-down approaches of antibodies provide a good balance of resolution, site-specificity, and proteoform heterogeneity to characterize individual proteoforms at subunit level. Currently, most middle-down studies focus on terminal fragment ions, which may not cover or resolve PTMs in the center of the sequence or with minor mass shifts such as deamidation, often a critical quality attribute for antibody drugs. Antibody glycosylation at Asn 297 and deamidation at Asn 325 are two important PTMs impacting the interaction with Fc gamma receptors and hence effector functions such as antibody-dependent cellular cytotoxicity. Here, we established a new middle-down workflow that uses internal fragment ions for the qualitative and quantitative assessment of a functional relevant deamidation site, Asn 325, through higher energy collision dissociation fragmentation of individual antibody glycoforms upon quadrupole isolation. We identified a signature internal fragment ion to resolve and estimate the relative abundances of deamidation of individual glycoforms in complex mixtures. Our proof-of-concept work demonstrates the feasibility to identify and quantify Asn 325 deamidation at the glycoform-resolved subunit level using internal fragment ions, which greatly advances the capabilities to study PTM dynamics by middle-down analysis.
中文翻译:

来自较高能量碰撞解离的内部碎片离子能够通过中下质谱法对抗体进行糖型解析的 Asn325 脱酰胺评估
蛋白质组表征的一个主要挑战是获取有关共存翻译后修饰 (PTM) 的信息,而传统的自下而上分析中会丢失这些信息。抗体的中下方法提供了分辨率、位点特异性和蛋白质型异质性的良好平衡,以在亚基水平上表征各个蛋白质型。目前,大多数中下研究都集中在末端碎片离子,这可能无法覆盖或解析序列中心的 PTM,或者具有较小的质量变化(例如脱酰胺作用),而这通常是抗体药物的关键质量属性。Asn 297 处的抗体糖基化和 Asn 325 处的脱酰胺化是两个重要的 PTM,影响与 Fc γ 受体的相互作用,从而影响抗体依赖性细胞毒性等效应子功能。在这里,我们建立了一个新的中下工作流程,通过四极分离后单个抗体糖型的更高能量碰撞解离碎片,使用内部碎片离子对功能相关脱酰胺位点 Asn 325 进行定性和定量评估。我们确定了一个特征性内部碎片离子,用于解析和估计复杂混合物中单个糖型脱酰胺的相对丰度。我们的概念验证工作证明了使用内部碎片离子在糖型解析的亚基水平上识别和量化 Asn 325 脱酰胺的可行性,这极大地提高了通过中下分析研究 PTM 动力学的能力。
更新日期:2023-10-30
中文翻译:

来自较高能量碰撞解离的内部碎片离子能够通过中下质谱法对抗体进行糖型解析的 Asn325 脱酰胺评估
蛋白质组表征的一个主要挑战是获取有关共存翻译后修饰 (PTM) 的信息,而传统的自下而上分析中会丢失这些信息。抗体的中下方法提供了分辨率、位点特异性和蛋白质型异质性的良好平衡,以在亚基水平上表征各个蛋白质型。目前,大多数中下研究都集中在末端碎片离子,这可能无法覆盖或解析序列中心的 PTM,或者具有较小的质量变化(例如脱酰胺作用),而这通常是抗体药物的关键质量属性。Asn 297 处的抗体糖基化和 Asn 325 处的脱酰胺化是两个重要的 PTM,影响与 Fc γ 受体的相互作用,从而影响抗体依赖性细胞毒性等效应子功能。在这里,我们建立了一个新的中下工作流程,通过四极分离后单个抗体糖型的更高能量碰撞解离碎片,使用内部碎片离子对功能相关脱酰胺位点 Asn 325 进行定性和定量评估。我们确定了一个特征性内部碎片离子,用于解析和估计复杂混合物中单个糖型脱酰胺的相对丰度。我们的概念验证工作证明了使用内部碎片离子在糖型解析的亚基水平上识别和量化 Asn 325 脱酰胺的可行性,这极大地提高了通过中下分析研究 PTM 动力学的能力。































 京公网安备 11010802027423号
京公网安备 11010802027423号