当前位置:
X-MOL 学术
›
ACS Appl. Nano Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
负载 p65 siRNA 的丁福明/DNA 纳米棱柱通过抑制 NLRP3 介导的细胞焦亡减轻急性肺损伤
ACS Applied Nano Materials ( IF 5.3 ) Pub Date : 2023-10-26 , DOI: 10.1021/acsanm.3c03893
Qianyi You 1 , Qiao Hu 2 , Chaowang Huang 2 , Jing Xu 2 , Yawen Guo 2 , Dan Wang 2 , Xiaolong Chen 2 , Hang Qian 1 , Mingdong Hu 2
ACS Applied Nano Materials ( IF 5.3 ) Pub Date : 2023-10-26 , DOI: 10.1021/acsanm.3c03893
Qianyi You 1 , Qiao Hu 2 , Chaowang Huang 2 , Jing Xu 2 , Yawen Guo 2 , Dan Wang 2 , Xiaolong Chen 2 , Hang Qian 1 , Mingdong Hu 2
Affiliation
|
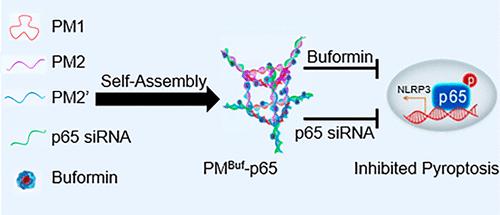
急性肺损伤(ALI)和急性呼吸窘迫综合征由复杂的分子机制引发,是危重患者高死亡率的主要原因。最近的研究表明,细胞焦亡导致高水平 IL-1β 和 IL-18 的释放,在引起细胞因子风暴、导致严重呼吸损伤的过程中发挥着关键作用。DNA纳米结构具有生物相容性、可编程性、生物降解性和无毒性等理想特性,使其适合用作药物输送载体。在这项研究中,发现DNA纳米棱柱作为传递丁双胍的载体,丁双胍不仅作为DNA组装的介质,而且还是抑制NOD样受体家族pyrin结构域3(NLRP3)的药物-介导的细胞焦亡。为了增强丁福明的治疗效果,将六个 p65 siRNA 分子装载到 DNA 纳米棱柱上。丁福明和 p65 siRNA 均表现出对 NLRP3 介导的细胞焦亡的显着抑制作用。此外,在体外巨噬细胞焦亡模型和ALI小鼠体内模型中研究了负载p65 siRNA的丁福明/DNA纳米棱柱通过抑制细胞焦亡来降低炎症水平的协同效应。总之,这种DNA纳米平台有可能改变未来ALI的治疗方法,因为它同时携带两种治疗药物,产生协同治疗效果。这种提出的方法提供了可以提高 ALI 治疗整体有效性的新策略。

"点击查看英文标题和摘要"
更新日期:2023-10-26

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号