当前位置:
X-MOL 学术
›
Molecular Biomedicine
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
血管钙化:从串扰的角度
Molecular Biomedicine Pub Date : 2023-10-18 , DOI: 10.1186/s43556-023-00146-y
Shiqi Yang 1, 2 , Zhaolin Zeng 1 , Qing Yuan 1, 2 , Qian Chen 1 , Zuo Wang 3 , Hui Xie 4 , Jianghua Liu 1

"点击查看英文标题和摘要"
更新日期:2023-10-18
Molecular Biomedicine Pub Date : 2023-10-18 , DOI: 10.1186/s43556-023-00146-y
Shiqi Yang 1, 2 , Zhaolin Zeng 1 , Qing Yuan 1, 2 , Qian Chen 1 , Zuo Wang 3 , Hui Xie 4 , Jianghua Liu 1
Affiliation
|
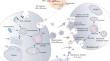
血管钙化(VC)与心血管疾病的发病率和死亡率高度相关,但由于分子机制不明确,抗 VC 治疗仍然是一个有待解决的领域。无论何种类型的VC,其都不依赖于单一细胞,而是涉及多个细胞/器官通过血管微环境形成复杂的细胞通讯网络,参与VC的发生和发展。因此,仅仅关注病理因素对血管平滑肌细胞(VSMC)的直接影响往往会忽视其他细胞和VSMC的联合作用,包括VSMCs-VSMCs、ECs-VMSCs、巨噬细胞-VSMCs等。 )是细胞主动分泌的具有膜结构的微小囊泡的统称,几乎所有细胞都会分泌EV。停靠在受体细胞表面的EV可以直接介导信号转导或将其内容物转移到细胞中以引发受体细胞的功能反应。它们已被证明可以参与 VC 过程,并且也显示出有吸引力的治疗前景。基于EV的优势以及在体液中检测的能力,它们未来可能成为新型治疗剂、药物输送载体、诊断和预后生物标志物以及潜在的治疗靶点。本文重点从串扰的角度对 VC 分子机制进行了新的见解,总结了多细胞/器官相互作用如何通过 EV 进行通信以调节 VC 以及 EV 作为 VC 治疗方法的新兴潜力。我们还总结了基于串扰的临床前实验以及 VC 相关措施的临床研究现状。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号