当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
揭示 GRB2 的亚稳态系综以及折叠过程中域间通信的相关性
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2023-10-12 , DOI: 10.1021/acs.jcim.3c00955
Raphael V R Dias 1, 2 , Renan P Pedro 1, 2 , Murilo N Sanches 1 , Giovana C Moreira 1, 2 , Vitor B P Leite 1 , Icaro P Caruso 1, 2 , Fernando A de Melo 1, 2 , Leandro C de Oliveira 1
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2023-10-12 , DOI: 10.1021/acs.jcim.3c00955
Raphael V R Dias 1, 2 , Renan P Pedro 1, 2 , Murilo N Sanches 1 , Giovana C Moreira 1, 2 , Vitor B P Leite 1 , Icaro P Caruso 1, 2 , Fernando A de Melo 1, 2 , Leandro C de Oliveira 1
Affiliation
|
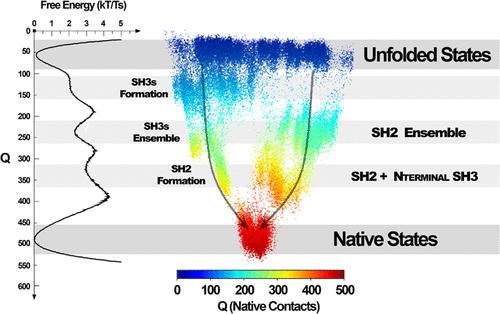
多结构域蛋白质的折叠过程是一种高度复杂的现象,涉及将不同结构域组装成功能性三维结构。在此过程中,每个域可以独立折叠,同时与其他域交互。多结构域蛋白质的折叠可能受到多种因素的影响,包括它们的组成、每个结构域的结构、无序区域的存在以及周围环境。多域蛋白的错误折叠可能导致形成与一系列疾病相关的非功能性结构,包括癌症或神经退行性疾病。了解这一过程是许多生物物理分析(例如稳定性、相互作用、故障和合理药物设计)的重要一步。其中一种多结构域蛋白是生长因子受体结合蛋白 2 (GRB2),它是调节细胞存活所必需的衔接蛋白。GRB2 由一个中心 Src 同源 2 (SH2) 结构域组成,两侧是两个 Src 同源 3 (SH3) 结构域。SH2 结构域与其他蛋白质中的磷酸酪氨酸区域相互作用,而 SH3 结构域在细胞信号传导过程中识别蛋白质伴侣上富含脯氨酸的区域。在这里,我们结合计算和实验技术来研究 GRB2 的折叠过程。通过计算模拟,我们对构象空间进行了采样,并绘制了自由能分布所涉及的机制,这可能表明可能的中间状态。从分子动力学轨迹来看,我们使用了能量景观可视化方法(ELViM),该方法使我们能够可视化整个能量表面的三维(3D)表示。我们确定了两种可能的平行折叠路线,在一维分析中看不到,其中一种在折叠过程中发生得更频繁。为了支持这些结果,我们使用差示扫描量热法(DSC)和荧光光谱技术在体外确认这些中间态。最后,我们分析了域的删除,将我们的模型输出与之前发布的结果进行比较,支持域间调制的存在。总体而言,我们的研究强调了 GRB2 蛋白内域间通讯的重要性及其对该蛋白的形成、稳定性和结构可塑性的影响,这对于其与关键信号通路中其他蛋白的相互作用至关重要。

"点击查看英文标题和摘要"
更新日期:2023-10-12

"点击查看英文标题和摘要"


































 京公网安备 11010802027423号
京公网安备 11010802027423号