当前位置:
X-MOL 学术
›
Chem. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
α/β-水解酶折叠处从水解催化到氧解催化的进化适应
Chemical Science ( IF 7.6 ) Pub Date : 2023-09-18 , DOI: 10.1039/d3sc03044j
Soi Bui 1 , Sara Gil-Guerrero 2 , Peter van der Linden 3 , Philippe Carpentier 4, 5 , Matteo Ceccarelli 6, 7 , Pablo G Jambrina 2 , Roberto A Steiner 1, 8
Chemical Science ( IF 7.6 ) Pub Date : 2023-09-18 , DOI: 10.1039/d3sc03044j
Soi Bui 1 , Sara Gil-Guerrero 2 , Peter van der Linden 3 , Philippe Carpentier 4, 5 , Matteo Ceccarelli 6, 7 , Pablo G Jambrina 2 , Roberto A Steiner 1, 8
Affiliation
|
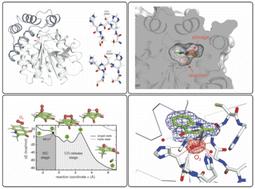
蛋白质折叠适应新的酶反应是一个基本的进化过程。降解N-杂芳族底物的不依赖辅因子的加氧酶属于 α/β-水解酶 (ABH) 折叠超家族,通常不催化氧化反应。在这里,我们将常氧和高氧条件下的晶体学分析与分子动力学和量子力学计算相结合,以研究其原型 1- H -3-羟基-4-氧代喹哪啶 2,4-双加氧酶 (HOD) 成员。O 2定位到发生催化的“氧阴离子孔”是不利的事件,并且双氧和水之间对该位点的直接竞争由“亲核弯头”残基调节。与有机底物结合位点重叠的疏水口袋可以充当近端双氧储存器。冷冻阱加压允许确定具有底物类似物和结合在氧阴离子孔处的O 2的三元复合物的结构。理论计算表明O 2方向与结合的有机配体的电荷耦合。当1- H -3-羟基-4-氧代喹哪啶不带电荷时,O 2与其分子轴沿着配体的C2-C4方向结合,与晶体结构完全一致。His-Asp 二联体对其 3-OH 基团的去质子化触发底物激活,使 O 2旋转约 60°。这种几何形状最大化了基底和O 2之间的电荷转移,从而削弱了后者的双键。电子密度转移至 O 2 (π*) 轨道可通过决定速率的系间窜越促进过氧化物中间体的形成。我们的工作详细描述了进化如何重新利用 ABH 折叠结构及其简单的催化机制来实现不依赖于金属的氧化。

"点击查看英文标题和摘要"
更新日期:2023-09-18

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号