Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
冷冻电子显微镜可视化的多结合位点表明谷氨酸脱氢酶上的辅酶结合途径
The FEBS Journal ( IF 5.5 ) Pub Date : 2023-09-08 , DOI: 10.1111/febs.16951
Taiki Wakabayashi 1, 2, 3 , Mao Oide 1, 2, 3, 4 , Takayuki Kato 5 , Masayoshi Nakasako 1, 2
The FEBS Journal ( IF 5.5 ) Pub Date : 2023-09-08 , DOI: 10.1111/febs.16951
Taiki Wakabayashi 1, 2, 3 , Mao Oide 1, 2, 3, 4 , Takayuki Kato 5 , Masayoshi Nakasako 1, 2
Affiliation
|
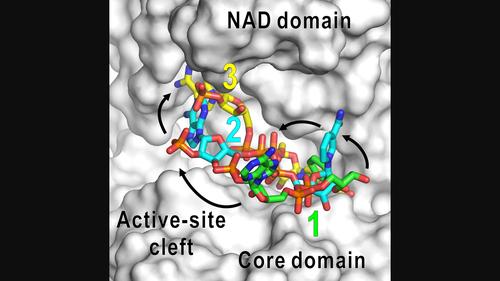
使用低温透射电子显微镜观察辅酶烟酰胺腺嘌呤二核苷酸磷酸 (NADP) 存在下的六聚谷氨酸脱氢酶 (GDH) 的结构,以研究酶活性位点的配体结合途径。GDH 的每个亚基包含一个六聚体形成核心结构域和一个核苷酸结合结构域(NAD 结构域),该结构域会自发地打开和关闭位于两个结构域之间的活性位点裂缝。在 NADP 存在的情况下,假设 D3 对称,GDH 六聚体的电位图以 2.4 Å 的分辨率确定,但由于构象变化,NAD 结构域变得模糊。在对 NAD 结构域进行集中分类后,解释为 NADP 分子的电位图出现在活性位点裂缝中的五个不同位点。与 NADP 分子相关的亚基接近未配体状态下的四种亚稳态构象之一。五个结合位点中的三个表明 NADP 分子接近活性位点裂缝以启动酶反应的途径。正如反应动力学所证明的那样,在谷氨酸存在的情况下,其他两种结合模式可能很少出现。基于可视化结构和酶动力学结果,我们讨论了在谷氨酸不存在和存在的情况下 NADP 与 GDH 的结合模式。

"点击查看英文标题和摘要"
更新日期:2023-09-08

"点击查看英文标题和摘要"




































 京公网安备 11010802027423号
京公网安备 11010802027423号