当前位置:
X-MOL 学术
›
J. Mol. Cell. Cardiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Myeloid-specific deletion of Capns1 attenuates myocardial infarction injury via restoring mitochondrial function and inhibiting inflammasome activation.
Journal of Molecular and Cellular Cardiology ( IF 4.9 ) Pub Date : 2023-09-07 , DOI: 10.1016/j.yjmcc.2023.08.006 Zilong Xiao 1 , Xiang Wei 2 , Minghui Li 3 , Kun Yang 1 , Ruizhen Chen 3 , Yangang Su 3 , Ziqing Yu 3 , Yixiu Liang 3 , Junbo Ge 3
Journal of Molecular and Cellular Cardiology ( IF 4.9 ) Pub Date : 2023-09-07 , DOI: 10.1016/j.yjmcc.2023.08.006 Zilong Xiao 1 , Xiang Wei 2 , Minghui Li 3 , Kun Yang 1 , Ruizhen Chen 3 , Yangang Su 3 , Ziqing Yu 3 , Yixiu Liang 3 , Junbo Ge 3
Affiliation
|
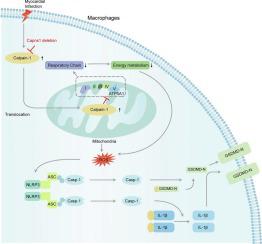
Mitochondrial dysfunction of macrophage-mediated inflammatory response plays a key pathophysiological process in myocardial infarction (MI). Calpains are a well-known family of calcium-dependent cysteine proteases that regulate a variety of processes, including cell adhesion, proliferation, and migration, as well as mitochondrial function and inflammation. CAPNS1, the common regulatory subunit of calpain-1 and 2, is essential for the stabilization and activity of the catalytic subunit. Emerging studies suggest that calpains may serve as key mediators in mitochondria and NLRP3 inflammasome. This study investigated the role of myeloid cell calpains in MI. MI models were constructed using myeloid-specific Capns1 knockout mice. Cardiac function, cardiac fibrosis, and inflammatory infiltration were investigated. In vitro, bone marrow-derived macrophages (BMDMs) were isolated from mice. Mitochondrial function and NLRP3 activation were assessed in BMDMs under LPS stimulation. ATP5A1 knockdown and Capns1 knock-out mice were subjected to MI to investigate their roles in MI injury. Ablation of calpain activities by Capns1 deletion improved the cardiac function, reduced infarct size, and alleviated cardiac fibrosis in mice subjected to MI. Mechanistically, Capns1 knockout reduced the cleavage of ATP5A1 and restored the mitochondria function thus inhibiting the inflammasome activation. ATP5A1 knockdown antagonized the protective effect of Capns1 mKO and aggravated MI injury. This study demonstrated that Capns1 depletion in macrophages mitigates MI injury via maintaining mitochondrial homeostasis and inactivating the NLRP3 inflammasome signaling pathway. This study may offer novel insights into MI injury treatment.
中文翻译:

骨髓特异性缺失 Capns1 通过恢复线粒体功能和抑制炎性小体激活来减轻心肌梗死损伤。
巨噬细胞介导的炎症反应的线粒体功能障碍在心肌梗死(MI)中发挥着关键的病理生理过程。钙蛋白酶是众所周知的钙依赖性半胱氨酸蛋白酶家族,可调节多种过程,包括细胞粘附、增殖和迁移,以及线粒体功能和炎症。 CAPNS1 是 calpain-1 和 2 的共同调节亚基,对于催化亚基的稳定和活性至关重要。新兴研究表明钙蛋白酶可能作为线粒体和 NLRP3 炎症小体的关键介质。本研究调查了骨髓细胞钙蛋白酶在 MI 中的作用。 MI 模型是使用骨髓特异性 Capns1 基因敲除小鼠构建的。研究了心脏功能、心脏纤维化和炎症浸润。在体外,从小鼠体内分离出骨髓源性巨噬细胞(BMDM)。在 LPS 刺激下评估 BMDM 中的线粒体功能和 NLRP3 激活。对 ATP5A1 敲低和 Capns1 敲除小鼠进行 MI,以研究它们在 MI 损伤中的作用。通过 Capns1 缺失消除钙蛋白酶活性可改善 MI 小鼠的心脏功能、缩小梗塞面积并减轻心脏纤维化。从机制上讲,Capns1 敲除减少了 ATP5A1 的裂解并恢复了线粒体功能,从而抑制了炎症小体的激活。 ATP5A1敲低拮抗Capns1 mKO的保护作用,加重心肌梗死损伤。这项研究表明,巨噬细胞中 Capns1 的缺失可以通过维持线粒体稳态和灭活 NLRP3 炎症小体信号通路来减轻 MI 损伤。这项研究可能为心肌梗死损伤治疗提供新的见解。
更新日期:2023-09-07
中文翻译:

骨髓特异性缺失 Capns1 通过恢复线粒体功能和抑制炎性小体激活来减轻心肌梗死损伤。
巨噬细胞介导的炎症反应的线粒体功能障碍在心肌梗死(MI)中发挥着关键的病理生理过程。钙蛋白酶是众所周知的钙依赖性半胱氨酸蛋白酶家族,可调节多种过程,包括细胞粘附、增殖和迁移,以及线粒体功能和炎症。 CAPNS1 是 calpain-1 和 2 的共同调节亚基,对于催化亚基的稳定和活性至关重要。新兴研究表明钙蛋白酶可能作为线粒体和 NLRP3 炎症小体的关键介质。本研究调查了骨髓细胞钙蛋白酶在 MI 中的作用。 MI 模型是使用骨髓特异性 Capns1 基因敲除小鼠构建的。研究了心脏功能、心脏纤维化和炎症浸润。在体外,从小鼠体内分离出骨髓源性巨噬细胞(BMDM)。在 LPS 刺激下评估 BMDM 中的线粒体功能和 NLRP3 激活。对 ATP5A1 敲低和 Capns1 敲除小鼠进行 MI,以研究它们在 MI 损伤中的作用。通过 Capns1 缺失消除钙蛋白酶活性可改善 MI 小鼠的心脏功能、缩小梗塞面积并减轻心脏纤维化。从机制上讲,Capns1 敲除减少了 ATP5A1 的裂解并恢复了线粒体功能,从而抑制了炎症小体的激活。 ATP5A1敲低拮抗Capns1 mKO的保护作用,加重心肌梗死损伤。这项研究表明,巨噬细胞中 Capns1 的缺失可以通过维持线粒体稳态和灭活 NLRP3 炎症小体信号通路来减轻 MI 损伤。这项研究可能为心肌梗死损伤治疗提供新的见解。

















































 京公网安备 11010802027423号
京公网安备 11010802027423号