当前位置:
X-MOL 学术
›
Chem. Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
近红外光驱动的 MOF@Au 纳米电机用于细菌生物膜的增强穿透和声动力治疗
Chemistry of Materials ( IF 7.2 ) Pub Date : 2023-08-16 , DOI: 10.1021/acs.chemmater.3c01140 Wei Guo 1, 2 , Yanmin Wang 1, 2 , Kai Zhang 1, 2 , Xiaoguang Dai 1, 2 , Zhuangzhuang Qiao 1, 2 , Zhiwen Liu 1, 2 , Bingran Yu 1, 2 , Nana Zhao 1, 2 , Fu-Jian Xu 1, 2
Chemistry of Materials ( IF 7.2 ) Pub Date : 2023-08-16 , DOI: 10.1021/acs.chemmater.3c01140 Wei Guo 1, 2 , Yanmin Wang 1, 2 , Kai Zhang 1, 2 , Xiaoguang Dai 1, 2 , Zhuangzhuang Qiao 1, 2 , Zhiwen Liu 1, 2 , Bingran Yu 1, 2 , Nana Zhao 1, 2 , Fu-Jian Xu 1, 2
Affiliation
|
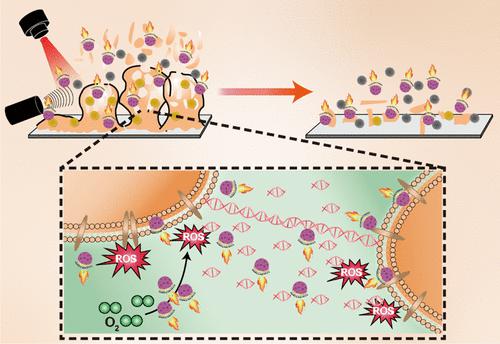
声动力疗法(SDT)利用超声波(US)激活声敏剂,产生高细胞毒性的活性氧化物(ROS),在根除深层细菌感染方面取得了巨大成功。然而,声敏剂在生物膜中的有限渗透和低扩散功效严重损害了 SDT 的治疗效果。在此,我们设计了一种具有高电子空穴对分离效率的近红外(NIR)光驱动纳米电机(MOF@Au-DNase I),用于对抗金黄色葡萄球菌(S. aureus ))生物膜。具体来说,将金纳米颗粒(Au NPs)沉积到一半球形金属有机框架(MOF)上构建Janus MOF@Au NPs,然后将脱氧核糖核酸酶(DNase I)共价固定到MOF表面@Au。在近红外激光照射下,MOF@Au NPs表现出高效的主动运动,并在15分钟内快速渗透到深层生物膜中。值得注意的是,DNase I 可以通过水解生物膜中的细胞外 DNA (eDNA) 来破坏生物膜的致密性,以促进声敏剂的渗透。此外,Au的不对称空间分布可以显着提高MOF@Au的电子转移效率,最终增强ROS的产生。这种协同效应提高了 Janus MOF@Au NPs 的 SDT 介导治疗的效率。

"点击查看英文标题和摘要"
更新日期:2023-08-16

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号