Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
RING E3 连接酶 RNF125 的锌指 1 与 E2 相互作用以增强泛素化
Structure ( IF 4.4 ) Pub Date : 2023-08-03 , DOI: 10.1016/j.str.2023.07.007
Adam J Middleton 1 , Fareeda M Barzak 1 , Thornton J Fokkens 1 , Khanh Nguyen 1 , Catherine L Day 1

"点击查看英文标题和摘要"
更新日期:2023-08-03
Structure ( IF 4.4 ) Pub Date : 2023-08-03 , DOI: 10.1016/j.str.2023.07.007
Adam J Middleton 1 , Fareeda M Barzak 1 , Thornton J Fokkens 1 , Khanh Nguyen 1 , Catherine L Day 1
Affiliation
|
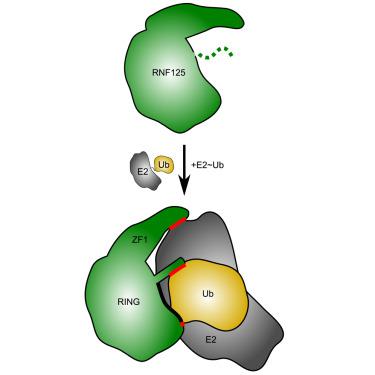
炎症对于健康的免疫功能、伤口愈合和感染解决至关重要。RIG-I 是一种关键的 RNA 传感器,可启动免疫反应,RIG-I 信号传导的激活和终止依赖于泛素的修饰。RING E3 泛素连接酶 RNF125 在减弱 RIG-I 信号传导中发挥着关键作用,但目前尚不清楚 RNF125 如何促进泛素转移或其活性如何受到调节。在这里,我们表明 RNF125 的 E3 连接酶活性依赖于第一个锌指 (ZF1) 以及 RING 结构域。令人惊讶的是,ZF1 有助于招募 E2,而 RING 结构域的 N 端残基似乎可以激活 E2∼Ub 缀合物。这些发现有助于解释 RNF125 如何终止 RIG-I 依赖性炎症反应,并有助于解释 RNF125 对疾病的影响。这项研究还揭示了 ZF 结构域在 E3 连接酶中的新作用。

"点击查看英文标题和摘要"




































 京公网安备 11010802027423号
京公网安备 11010802027423号