当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
α-螺旋介导的蛋白质粘附
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-07-28 , DOI: 10.1021/jacs.3c03581
Yingying Zhang 1 , Yongchun Liu 1 , Yonggang Liu 2 , Ping Zuo 1 , Shuting Miao 1 , Bowen Hu 1 , Yu Kang 2 , Wei Liu 1 , Qingmin Yang 3 , Hao Ren 1 , Peng Yang 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-07-28 , DOI: 10.1021/jacs.3c03581
Yingying Zhang 1 , Yongchun Liu 1 , Yonggang Liu 2 , Ping Zuo 1 , Shuting Miao 1 , Bowen Hu 1 , Yu Kang 2 , Wei Liu 1 , Qingmin Yang 3 , Hao Ren 1 , Peng Yang 1
Affiliation
|
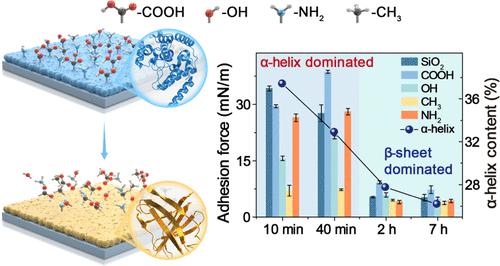
蛋白质已被天然生物体用来制造坚固的生物粘附材料,例如微生物和藤壶中形成的生物膜和淀粉样斑块。在这些情况下,β-折叠堆积被认为是与蛋白质界面粘附密切相关的关键特征。在此,我们通过提出α-螺旋介导的蛋白质界面粘附模型来挑战这一众所周知的认识。通过使用牛血清白蛋白(BSA)作为模型蛋白,发现 BSA 中二硫键的还原导致未折叠的 BSA 形成随机卷曲,拖动 α 螺旋聚集在固/液界面(SLI)处。然后α-螺旋中的疏水残基暴露并突破SLI的水化层,随后亲水和疏水残基随机沉积以实现界面粘附。因此,第一个组装层富含 α 螺旋二级结构,然后通过分子间二硫键加强,并进一步启动逐步分层的蛋白质组装。在此过程中,β-折叠堆叠由α-螺旋以逐渐演化的方式转变。因此,这一发现表明,蛋白质界面粘附后可能形成具有β-折叠特征的淀粉样蛋白。此外,α-螺旋介导的蛋白质界面粘附模型的发现提供了一种独特的策略来制备具有明确层数的蛋白质纳米膜,在各种基材上呈现出强大且可调节的粘附力,并表现出良好的耐酸、碱、有机物的能力。溶剂、超声波和胶带剥离。

"点击查看英文标题和摘要"
更新日期:2023-07-28

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号