当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
大肠杆菌 DHFR 中的动态局部相互作用可控制酶抑制的动力学屏障
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2023-07-25 , DOI: 10.1021/acs.jcim.3c00818 Ebru Cetin 1 , Tandac F Guclu 1 , Isik Kantarcioglu 1, 2 , Ilona K Gaszek 2 , Erdal Toprak 2 , Ali Rana Atilgan 1 , Burcu Dedeoglu 3 , Canan Atilgan 1
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2023-07-25 , DOI: 10.1021/acs.jcim.3c00818 Ebru Cetin 1 , Tandac F Guclu 1 , Isik Kantarcioglu 1, 2 , Ilona K Gaszek 2 , Erdal Toprak 2 , Ali Rana Atilgan 1 , Burcu Dedeoglu 3 , Canan Atilgan 1
Affiliation
|
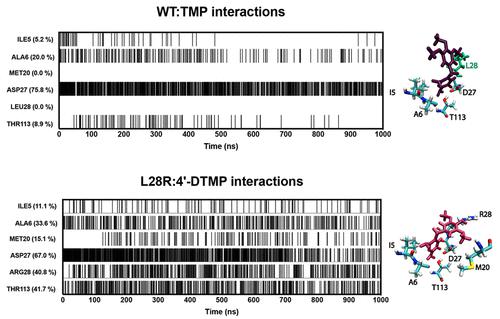
二氢叶酸还原酶 (DHFR) 是一个重要的药物靶点,也是一种用于了解酶动力学的经过深入研究的模型蛋白。DHFR 在叶酸合成中的关键作用使其成为了解蛋白质功能和蛋白质进化机制的理想候选者。在这项研究中,为了了解新提出的 DHFR 抑制剂 4'-脱氧甲基甲氧苄啶 (4'-DTMP) 如何改变进化轨迹,我们研究了导致其性能优于甲氧苄啶 (TMP) 的相互作用。为了阐明 4'-DTMP 的抑制机制,我们首先通过计算和实验证实,TMP 和 4'-DTMP 突变的相对结合自由能成本是相同的,指出特征差异的根源是动力学而非热力学。然后,我们采用基于相互作用的分析,首先关注活性位点,然后关注整个酶。我们证实 4'-DTMP 中的极性修饰会诱导与酶的额外局部相互作用,特别是 M20 环。随着氢键网络的变化,这些变化会传播到整个酶。为了阐明变构相互作用,我们通过基于网络的群落分析来支持我们的分析,并表明成功的抑制剂必须避免抑制剂结合的 DHFR 环域的分割。

"点击查看英文标题和摘要"
更新日期:2023-07-25

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号