Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
CD38-Specific CAR Integrated into CD38 Locus Driven by Different Promoters Causes Distinct Antitumor Activities of T and NK Cells
Advanced Science ( IF 14.3 ) Pub Date : 2023-07-23 , DOI: 10.1002/advs.202207394 Chan Liao 1 , Yajie Wang 2, 3, 4 , Yanjie Huang 5, 6 , Yanting Duan 2, 3, 4 , Yan Liang 2 , Jiangqing Chen 2, 3, 4 , Jie Jiang 2, 3, 4 , Kai Shang 2, 3, 4 , Chun Zhou 7 , Ying Gu 8 , Nan Liu 2 , Xun Zeng 9 , Xiaofei Gao 5 , Yongmin Tang 1 , Jie Sun 2, 3, 4
Advanced Science ( IF 14.3 ) Pub Date : 2023-07-23 , DOI: 10.1002/advs.202207394 Chan Liao 1 , Yajie Wang 2, 3, 4 , Yanjie Huang 5, 6 , Yanting Duan 2, 3, 4 , Yan Liang 2 , Jiangqing Chen 2, 3, 4 , Jie Jiang 2, 3, 4 , Kai Shang 2, 3, 4 , Chun Zhou 7 , Ying Gu 8 , Nan Liu 2 , Xun Zeng 9 , Xiaofei Gao 5 , Yongmin Tang 1 , Jie Sun 2, 3, 4
Affiliation
|
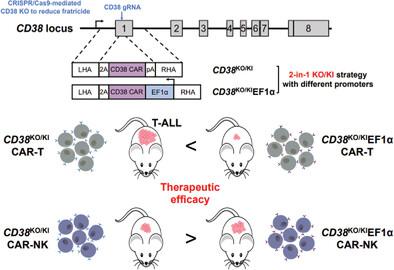
The robust and stable expression of CD38 in T-cell acute lymphoblastic leukemia (T-ALL) blasts makes CD38 chimeric antigen receptor (CAR)-T/natural killer (NK) a potential therapy for T-ALL. However, CD38 expression in normal T/NK cells causes fratricide of CD38 CAR-T/NK cells. Here a “2-in-1” gene editing strategy is developed to generate fratricide-resistant locus-specific CAR-T/NK cells. CD38-specific CAR is integrated into the disrupted CD38 locus by CRISPR/Cas9, and CAR is placed under the control of either endogenous CD38 promoter (CD38KO/KI) or exogenous EF1α promoter (CD38KO/KIEF1α). CD38 knockout reduces fratricide and allows the expansion of CAR-T cells. Meanwhile, CD38KO/KIEF1α results in higher CAR expression than CD38KO/KI in both CAR-T and CAR-NK cells. In a mouse T-ALL model, CD38KO/KIEF1α CAR-T cells eradicate tumors better than CD38KO/KI CAR-T cells. Surprisingly, CD38KO/KI CAR-NK cells show superior tumor control than CD38KO/KIEF1α CAR-NK cells. Further investigation reveals that endogenous regulatory elements in NK cells lead to higher expression of CD38 CAR than in T cells, and the expression levels of CAR affect the therapeutic outcome of CAR-T and CAR-NK cells differently. Therefore, these results support the efficacy of CD38 CAR-T/NK against T-ALL and demonstrate that the “2-in-1” strategy can resolve fratricide and enhance tumor eradication, paving the way for clinical translation.
中文翻译:

由不同启动子驱动的 CD38 特异性 CAR 整合到 CD38 位点导致 T 细胞和 NK 细胞具有不同的抗肿瘤活性
CD38 在 T 细胞急性淋巴细胞白血病 (T-ALL) 母细胞中的强劲和稳定表达使得 CD38 嵌合抗原受体 (CAR)-T/自然杀伤 (NK) 成为 T-ALL 的潜在疗法。然而,正常T/NK细胞中的CD38表达会导致CD38 CAR-T/NK细胞自相残杀。这里开发了一种“二合一”基因编辑策略来生成抗自相残杀的基因座特异性 CAR-T/NK 细胞。CD38 特异性 CAR 通过 CRISPR/Cas9 整合到破坏的CD38基因座中,并且 CAR 置于内源 CD38 启动子 ( CD38 KO/KI ) 或外源 EF1α 启动子 ( CD38 KO/KI EF1α)的控制之下。CD38 敲除可减少自相残杀并允许 CAR-T 细胞扩增。同时,在 CAR-T 和 CAR-NK 细胞中,CD38 KO/KI EF1α 导致比CD38 KO/KI更高的 CAR 表达。在小鼠 T-ALL 模型中,CD38 KO/KI EF1α CAR-T 细胞比CD38 KO/KI CAR-T 细胞更好地根除肿瘤。令人惊讶的是,CD38 KO/KI CAR-NK 细胞比CD38 KO/KI EF1α CAR-NK 细胞表现出更好的肿瘤控制能力。进一步研究发现,NK细胞中的内源性调控元件导致CD38 CAR的表达高于T细胞,并且CAR的表达水平对CAR-T和CAR-NK细胞的治疗结果产生不同的影响。因此,这些结果支持了CD38 CAR-T/NK对抗T-ALL的功效,并证明“二合一”策略可以解决自相残杀并增强肿瘤根除,为临床转化铺平道路。
更新日期:2023-07-23
中文翻译:

由不同启动子驱动的 CD38 特异性 CAR 整合到 CD38 位点导致 T 细胞和 NK 细胞具有不同的抗肿瘤活性
CD38 在 T 细胞急性淋巴细胞白血病 (T-ALL) 母细胞中的强劲和稳定表达使得 CD38 嵌合抗原受体 (CAR)-T/自然杀伤 (NK) 成为 T-ALL 的潜在疗法。然而,正常T/NK细胞中的CD38表达会导致CD38 CAR-T/NK细胞自相残杀。这里开发了一种“二合一”基因编辑策略来生成抗自相残杀的基因座特异性 CAR-T/NK 细胞。CD38 特异性 CAR 通过 CRISPR/Cas9 整合到破坏的CD38基因座中,并且 CAR 置于内源 CD38 启动子 ( CD38 KO/KI ) 或外源 EF1α 启动子 ( CD38 KO/KI EF1α)的控制之下。CD38 敲除可减少自相残杀并允许 CAR-T 细胞扩增。同时,在 CAR-T 和 CAR-NK 细胞中,CD38 KO/KI EF1α 导致比CD38 KO/KI更高的 CAR 表达。在小鼠 T-ALL 模型中,CD38 KO/KI EF1α CAR-T 细胞比CD38 KO/KI CAR-T 细胞更好地根除肿瘤。令人惊讶的是,CD38 KO/KI CAR-NK 细胞比CD38 KO/KI EF1α CAR-NK 细胞表现出更好的肿瘤控制能力。进一步研究发现,NK细胞中的内源性调控元件导致CD38 CAR的表达高于T细胞,并且CAR的表达水平对CAR-T和CAR-NK细胞的治疗结果产生不同的影响。因此,这些结果支持了CD38 CAR-T/NK对抗T-ALL的功效,并证明“二合一”策略可以解决自相残杀并增强肿瘤根除,为临床转化铺平道路。































 京公网安备 11010802027423号
京公网安备 11010802027423号