当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Chemoproteomics Yields a Selective Molecular Host for Acetyl-CoA
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-07-24 , DOI: 10.1021/jacs.3c05489
Whitney K Lieberman 1 , Zachary A Brown 1 , Daniel S Kantner 2 , Yihang Jing 1 , Emily Megill 2 , Nya D Evans 1 , McKenna C Crawford 1 , Isita Jhulki 1 , Carissa Grose 3 , Jane E Jones 3 , Nathaniel W Snyder 2 , Jordan L Meier 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-07-24 , DOI: 10.1021/jacs.3c05489
Whitney K Lieberman 1 , Zachary A Brown 1 , Daniel S Kantner 2 , Yihang Jing 1 , Emily Megill 2 , Nya D Evans 1 , McKenna C Crawford 1 , Isita Jhulki 1 , Carissa Grose 3 , Jane E Jones 3 , Nathaniel W Snyder 2 , Jordan L Meier 1
Affiliation
|
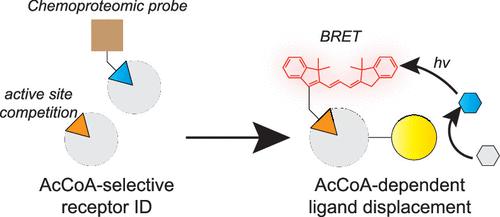
Chemoproteomic profiling is a powerful approach to define the selectivity of small molecules and endogenous metabolites with the human proteome. In addition to mechanistic studies, proteome specificity profiling also has the potential to identify new scaffolds for biomolecular sensing. Here, we report a chemoproteomics-inspired strategy for selective sensing of acetyl-CoA. First, we use chemoproteomic capture experiments to validate the N-terminal acetyltransferase NAA50 as a protein capable of differentiating acetyl-CoA and CoA. A Nanoluc-NAA50 fusion protein retains this specificity and can be used to generate a bioluminescence resonance energy transfer (BRET) signal in the presence of a CoA-linked fluorophore. This enables the development of a ligand displacement assay in which CoA metabolites are detected via their ability to bind the Nanoluc-NAA50 protein “host” and compete binding of the CoA-linked fluorophore “guest”. We demonstrate that the specificity of ligand displacement reflects the molecular recognition of the NAA50 host, while the window of dynamic sensing can be controlled by tuning the binding affinity of the CoA-linked fluorophore guest. Finally, we show that the method’s specificity for acetyl-CoA can be harnessed for gain-of-signal optical detection of enzyme activity and quantification of acetyl-CoA from cellular samples. Overall, our studies demonstrate the potential of harnessing insights from chemoproteomics for molecular sensing and provide a foundation for future applications in target engagement and selective metabolite detection.
中文翻译:

化学蛋白质组学产生乙酰辅酶A的选择性分子宿主
化学蛋白质组学分析是定义小分子和内源代谢物与人类蛋白质组的选择性的有效方法。除了机制研究之外,蛋白质组特异性分析还具有识别用于生物分子传感的新支架的潜力。在这里,我们报告了一种受化学蛋白质组学启发的乙酰辅酶A选择性传感策略。首先,我们使用化学蛋白质组学捕获实验来验证 N 末端乙酰转移酶 NAA50 作为能够区分乙酰辅酶 A 和 CoA 的蛋白质。 Nanoluc-NAA50 融合蛋白保留了这种特异性,可用于在 CoA 连接荧光团存在的情况下产生生物发光共振能量转移 (BRET) 信号。这使得配体置换测定得以开发,其中 CoA 代谢物通过其结合 Nanoluc-NAA50 蛋白“宿主”并竞争结合 CoA 连接的荧光团“客体”的能力来检测。我们证明配体置换的特异性反映了 NAA50 宿主的分子识别,而动态传感的窗口可以通过调整 CoA 连接的荧光团客体的结合亲和力来控制。最后,我们证明该方法对乙酰辅酶A的特异性可用于酶活性的信号增益光学检测和细胞样品中乙酰辅酶A的定量。总的来说,我们的研究证明了利用化学蛋白质组学见解进行分子传感的潜力,并为未来在目标参与和选择性代谢物检测中的应用奠定了基础。
更新日期:2023-07-24
中文翻译:

化学蛋白质组学产生乙酰辅酶A的选择性分子宿主
化学蛋白质组学分析是定义小分子和内源代谢物与人类蛋白质组的选择性的有效方法。除了机制研究之外,蛋白质组特异性分析还具有识别用于生物分子传感的新支架的潜力。在这里,我们报告了一种受化学蛋白质组学启发的乙酰辅酶A选择性传感策略。首先,我们使用化学蛋白质组学捕获实验来验证 N 末端乙酰转移酶 NAA50 作为能够区分乙酰辅酶 A 和 CoA 的蛋白质。 Nanoluc-NAA50 融合蛋白保留了这种特异性,可用于在 CoA 连接荧光团存在的情况下产生生物发光共振能量转移 (BRET) 信号。这使得配体置换测定得以开发,其中 CoA 代谢物通过其结合 Nanoluc-NAA50 蛋白“宿主”并竞争结合 CoA 连接的荧光团“客体”的能力来检测。我们证明配体置换的特异性反映了 NAA50 宿主的分子识别,而动态传感的窗口可以通过调整 CoA 连接的荧光团客体的结合亲和力来控制。最后,我们证明该方法对乙酰辅酶A的特异性可用于酶活性的信号增益光学检测和细胞样品中乙酰辅酶A的定量。总的来说,我们的研究证明了利用化学蛋白质组学见解进行分子传感的潜力,并为未来在目标参与和选择性代谢物检测中的应用奠定了基础。

































 京公网安备 11010802027423号
京公网安备 11010802027423号