当前位置:
X-MOL 学术
›
Free Radical Bio. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过与肽基-脯氨酰顺反异构酶 NIMA 相互作用的直接相互作用,HIF-2α 在乳腺癌中不依赖氧地稳定 1
Free Radical Biology and Medicine ( IF 7.1 ) Pub Date : 2023-07-19 , DOI: 10.1016/j.freeradbiomed.2023.07.020
Yanymee N Guillen-Quispe 1 , Su-Jung Kim 2 , Soma Saeidi 1 , Tianchi Zhou 3 , Jie Zheng 2 , Seong Hoon Kim 2 , Xizhu Fang 2 , Chaithanya Chelakkot 4 , Milton E Rios-Castillo 5 , Young Kee Shin 6 , Young-Joon Surh 7
Affiliation
|
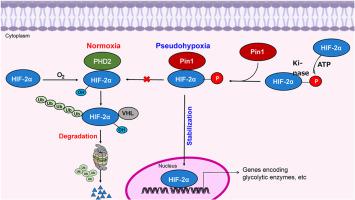
肽基-脯氨酰顺反异构酶 NIMA 相互作用 1 (Pin1) 在检测靶蛋白的磷酸化丝氨酸 (Ser) 或苏氨酸 (Thr) 时,会异构化附近的脯氨酸 (Pro) 残基,从而改变其结构、稳定性、功能以及与其他蛋白的相互作用。缺氧诱导因子 2α (HIF-2α) 是一种在缺氧条件下反式激活许多致癌基因的转录因子,具有 pSer/Thr-Pro 基序。我们首次发现 Pin1 在人乳腺癌细胞的常氧和缺氧条件下与 HIF-2α 物理结合。Pin1 敲低显著提高了泛素化 HIF-2α 的水平,而其 mRNA 转录本的表达不受影响。与这一观察结果一致,放线菌酮追踪测定表明 Pin1 延长了 HIF-2α 的稳定性。发现 HIF-2α 的丝氨酸 672、696 和 790 发生磷酸化。其中,参与 Pin1 结合和 HIF-2α 稳定化的主要氨基酸被鉴定为丝氨酸 790,位于 HIF-2α 的核输出信号区域。与邻近正常组织相比,人乳腺癌标本的组织阵列显示 HIF-2α 和 Pin1 的表达升高。敲低 Pin1 或 HIF-2α 减少了乳腺癌细胞迁移和集落形成。总之,Pin1 通过直接相互作用稳定 HIF-2α,这有助于乳腺癌的生长。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号