当前位置:
X-MOL 学术
›
ACS Pharmacol. Transl. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
鉴定对趋化因子受体 CXCR1 而非 CXCR2 具有重要功能的盐桥
ACS Pharmacology & Translational Science ( IF 4.9 ) Pub Date : 2023-07-14 , DOI: 10.1021/acsptsci.3c00070
Jon Våbenø 1 , Marta Oliva-Santiago 2 , Astrid S Jørgensen 2 , Stefanie Karlshøj 2 , Mette M Rosenkilde 2
Affiliation
|
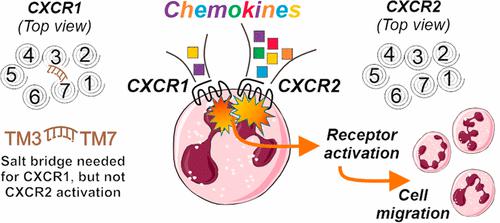
CXC 趋化因子受体 1 (CXCR1) 和 2 (CXCR2) 具有高度序列相似性和重叠的趋化因子配体谱。残基位置 3.32 和 7.39 对于相关 CXCR4 中的信号转导至关重要,并且在这些位置 CXCR1 和 CXCR2 包含带相反电荷的残基(Lys 3.32和 Glu 7.39 )。实验和计算的受体结构揭示了跨膜(TM)螺旋3和7之间可能通过这两个残基形成盐桥。为了研究 CXCR1 中 Lys117 3.32和 Glu291 7.39以及侧翼 Glu118 3.33的功能重要性,我们使用两种不同的 CXCL8 同工型对 16 个 CXCR1 突变体进行了信号传导研究。单丙氨酸突变(K117 3.32 A、E291 7.39 A)和电荷反转(K117 3.32 E、E291 7.39 K)导致受体无功能,而双突变(K117 3.32 E-E291 7.39 K)和三突变(K117 3.32 E-E118 3.33 ) A-E291 7.39 K) 突变体挽救了 CXCR1 功能。相反,相应的突变并没有对CXCR2功能产生相同程度的影响。我们的研究结果表明,TM3 和 -7 之间的 Lys 3.32 -Glu 7.39盐桥在功能上对 CXCR1 很重要,但对 CXCR2 则不然,这意味着这些高度同源受体的信号转导不保守。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号