当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
ATP 竞争性和新型非竞争性 Abbapolin 抑制剂诱导的 Polo 样激酶 1 构象和细胞内稳定性变化的结构基础
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2023-07-11 , DOI: 10.1021/acschembio.3c00269
Danda Chapagai 1 , George Merhej 1 , Campbell McInnes 1 , Michael D Wyatt 1
Affiliation
|
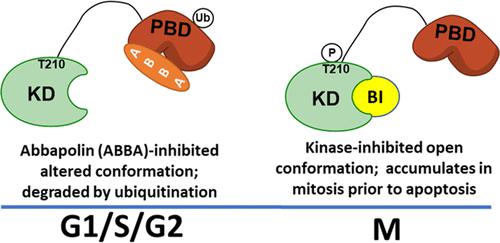
Polo 样激酶 1 (PLK1) 是一种必需蛋白激酶,在有丝分裂进展中具有多种作用。 PLK1 由激酶结构域 (KD) 和磷酸肽结合 polobox 结构域 (PBD) 组成,负责底物识别和亚细胞定位。 PLK1 的调节涉及 KD 和 PBD 相互作用的自抑制构象。我们之前的工作发现了称为 abbapolins 的 PBD 结合分子,可抑制 PLK1 底物的细胞磷酸化并诱导细胞内 PLK1 的丢失。在这里,我们描述了 abbapolin 活性与 KD 抑制剂的活性比较,以深入了解 PLK1 的构象特征。通过细胞热位移测定测量,abbabalins 产生配体诱导的 PLK1 热稳定性。相反,KD 抑制剂降低了可溶性 PLK1,这表明催化位点结合导致 PLK1 构象热稳定性较差。全长 PLK1 和 KD 抑制剂的结合测量也证明了构象变化。有趣的是,KD 与 PBD 结合的细胞后果形成鲜明对比,因为 KD 结合会导致细胞内 PLK1 的积累,而 PBD 结合会导致核 PLK1 的显着损失。这些数据与 KD 结合剂缓解 PLK1 自身抑制作用一致;使用 AlphaFold 预测的催化结构域和全长 PLK1 的结构对这些观察结果进行了解释。总的来说,这些结果凸显了靶向 PLK1 的一个未被充分认识的方面,即 KD 与 PBD 结合引起的构象扰动。 除了对 PBD 结合配体具有重要意义外,这些观察结果还对 ATP 竞争性 PLK1 抑制剂的开发具有影响,因为催化抑制剂可能反过来促进 PLK1 非催化功能,这可能解释了它们迄今为止缺乏临床疗效的原因。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号