当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
人小热休克蛋白 B8 抑制蛋白质聚集而不影响天然折叠过程
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-07-06 , DOI: 10.1021/jacs.3c02022 Dhawal Choudhary 1, 2, 3 , Laura Mediani 4 , Mario J Avellaneda 3 , Sveinn Bjarnason 5 , Simon Alberti 6 , Edgar E Boczek 6 , Pétur O Heidarsson 5 , Alessandro Mossa 2, 7 , Serena Carra 4 , Sander J Tans 3 , Ciro Cecconi 1, 2
Affiliation
|
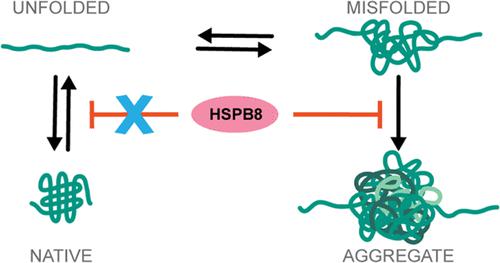
小热休克蛋白 (sHSP) 是我们蛋白质质量控制系统的关键组成部分,被认为可以充当中和不可逆蛋白质聚集的储存库。然而,sHSP 也可以充当隔离酶,促进蛋白质隔离成聚集体,从而挑战我们对其确切作用机制的理解。在这里,我们利用光镊探索人类小热休克蛋白 HSPB8 及其致病突变体 K141E 的作用机制,该突变体与神经肌肉疾病相关。通过单分子操作实验,我们研究了HSPB8及其K141E突变体如何影响麦芽糖结合蛋白的重折叠和聚集过程。我们的数据表明 HSPB8 选择性抑制蛋白质聚集而不影响天然折叠过程。这种抗聚集机制与之前的模型不同,之前的模型依赖于未折叠的多肽链或部分折叠结构的稳定性,正如其他分子伴侣所报道的那样。相反,HSPB8 似乎选择性地识别并结合在聚集早期形成的聚集物质,防止它们生长成更大的聚集结构。一致的是,K141E 突变专门针对聚集结构的亲和力,而不影响天然折叠,因此削弱了其抗聚集活性。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号