当前位置:
X-MOL 学术
›
J. Mater. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
合理设计类弹性蛋白多肽融合蛋白以调节蛋白囊泡的自组装和特性
Journal of Materials Chemistry B ( IF 6.1 ) Pub Date : 2023-06-26 , DOI: 10.1039/d3tb00200d
Yirui Li 1, 2 , Dylan R Dautel 1 , Mikaela A Gray 1 , Michael E McKenna 1 , Julie A Champion 1, 2
Journal of Materials Chemistry B ( IF 6.1 ) Pub Date : 2023-06-26 , DOI: 10.1039/d3tb00200d
Yirui Li 1, 2 , Dylan R Dautel 1 , Mikaela A Gray 1 , Michael E McKenna 1 , Julie A Champion 1, 2
Affiliation
|
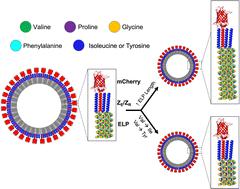
由生物活性蛋白制成的蛋白囊泡在药物输送、生物催化和作为人造细胞方面具有潜在价值。由于蛋白质是重组产生的,精确调节蛋白质序列的能力提供了聚合囊泡不可能实现的控制。可调性和生物相容性促使这项工作使用合理设计的蛋白质构建块来开发蛋白质囊泡,以研究蛋白质序列如何影响囊泡自组装和特性。我们报道了一种与富含精氨酸的亮氨酸拉链(Z R )融合的弹性蛋白样多肽(ELP )以及与富含谷氨酸的亮氨酸拉链融合的功能性球状蛋白(Z E)由于 ELP 的疏水性转变,当从 4°C 加热到 25°C 时,它们会自组装成蛋白囊泡。之前,我们证明了通过改变蛋白质和盐浓度、Z E : Z R比率和升温速率来调节囊泡特性的能力。然而,通过以下方式可以获得的属性是有限的:装配条件。为了获得更广泛的囊泡直径和稳定性特征,这项工作使用 mCherry 作为球状蛋白模型,研究了修饰 ELP 序列的疏水性和长度如何影响自组装和蛋白囊泡的最终特性。结果表明,蛋白囊泡的转变温度和直径均与ELP客体残基疏水性和ELP五肽重复次数呈负相关。此外,序列操作使得囊泡的组装能够通过改变组装条件来实现。例如,在 ELP 的 5 个客体残基位置引入酪氨酸能够形成在生理盐浓度下稳定的纳米级囊泡。

"点击查看英文标题和摘要"
更新日期:2023-06-27

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号