当前位置:
X-MOL 学术
›
Chem. Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Smart Microcapsules Designed for On-Demand Local Heating and Drug Release
Chemistry of Materials ( IF 7.2 ) Pub Date : 2023-06-07 , DOI: 10.1021/acs.chemmater.3c00517 Ji-Won Kim 1 , Sang Hoon Han 1 , Minhee Ku 2 , Jaemoon Yang 2 , Shin-Hyun Kim 1
Chemistry of Materials ( IF 7.2 ) Pub Date : 2023-06-07 , DOI: 10.1021/acs.chemmater.3c00517 Ji-Won Kim 1 , Sang Hoon Han 1 , Minhee Ku 2 , Jaemoon Yang 2 , Shin-Hyun Kim 1
Affiliation
|
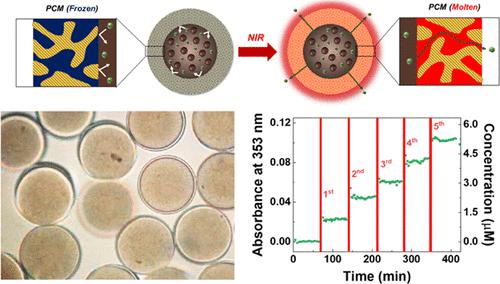
Chemophotothermal therapy is promising for cancer treatment with its synergistic effect. Although various photothermal agents have been formulated as drug carriers, low payload, burst release, and severe dilution usually restrict their uses. To overcome the limitations, we design smart microcapsules as a pragmatic material for chemophotothermal therapy. With a microfluidic device, water-in-oil-in-water (W/O/W) double-emulsion templates are produced to have photothermal polydopamine nanoparticles and drugs in the water core and a mixture of photocurable monomers and phase-change material (PCM) in the oil shell. The droplets are significantly shrunken by the osmotic extraction of water from the core, which enables the size reduction for the ease of injection and enrichment of polydopamine nanoparticles and drugs for enhanced photothermal performance and high payload. The microcapsules, produced by photopolymerization of monomers, release drugs when PCM in continuous nanochannels of the polymer shell is molten while retaining drugs without leakage when frozen. As the concentrated polydopamine nanoparticles provide rapid and drastic heating by near-infrared irradiation, the drug release can be switched on and off in a programmed manner by manipulating the irradiation. The smart microcapsules secure high drug payload in a spacious core, negligible initial bursting, and dilution-free high photothermal performance, potentially serving as a pragmatic therapy platform.
中文翻译:

专为按需局部加热和药物释放而设计的智能微胶囊
化学光热疗法因其协同作用而有望用于癌症治疗。尽管各种光热剂已被配制为药物载体,但低有效负载、爆发释放和严重稀释通常限制了它们的使用。为了克服这些限制,我们设计了智能微胶囊作为化学光热疗法的实用材料。利用微流控装置,制备出水包水包油包水(W/O/W)双乳液模板,水核中含有光热聚多巴胺纳米颗粒和药物,以及光固化单体和相变材料的混合物( PCM)在油壳中。通过从核心渗透提取水,液滴显着收缩,它可以减小尺寸,以便于注射和富集聚多巴胺纳米颗粒和药物,从而增强光热性能和高有效负载。由单体光聚合产生的微胶囊,当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而在冷冻时保留药物而不会泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而冷冻时保留药物而不泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而冷冻时保留药物而不泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。通过操纵照射,可以以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。通过操纵照射,可以以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。
更新日期:2023-06-07
中文翻译:

专为按需局部加热和药物释放而设计的智能微胶囊
化学光热疗法因其协同作用而有望用于癌症治疗。尽管各种光热剂已被配制为药物载体,但低有效负载、爆发释放和严重稀释通常限制了它们的使用。为了克服这些限制,我们设计了智能微胶囊作为化学光热疗法的实用材料。利用微流控装置,制备出水包水包油包水(W/O/W)双乳液模板,水核中含有光热聚多巴胺纳米颗粒和药物,以及光固化单体和相变材料的混合物( PCM)在油壳中。通过从核心渗透提取水,液滴显着收缩,它可以减小尺寸,以便于注射和富集聚多巴胺纳米颗粒和药物,从而增强光热性能和高有效负载。由单体光聚合产生的微胶囊,当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而在冷冻时保留药物而不会泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而冷冻时保留药物而不泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。当聚合物壳的连续纳米通道中的PCM熔化时释放药物,而冷冻时保留药物而不泄漏。由于浓缩的聚多巴胺纳米颗粒通过近红外辐射提供快速而剧烈的加热,因此可以通过操纵辐射以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。通过操纵照射,可以以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。通过操纵照射,可以以编程方式打开和关闭药物释放。智能微胶囊在宽敞的核心中确保高药物有效负载、可忽略不计的初始爆裂和免稀释的高光热性能,有可能作为实用的治疗平台。































 京公网安备 11010802027423号
京公网安备 11010802027423号