当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Metal-Pyridoxal Cooperativity in Nonenzymatic Transamination
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-06-06 , DOI: 10.1021/jacs.3c03542 Quentin Dherbassy 1 , Robert J Mayer 1 , Kamila B Muchowska 1 , Joseph Moran 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2023-06-06 , DOI: 10.1021/jacs.3c03542 Quentin Dherbassy 1 , Robert J Mayer 1 , Kamila B Muchowska 1 , Joseph Moran 1
Affiliation
|
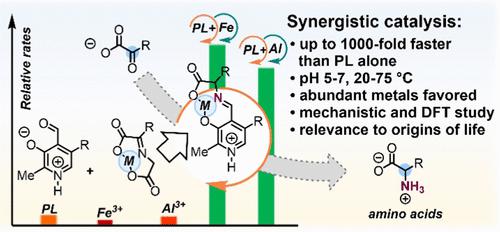
Coenzymes are involved in ≥30% of enzymatic reactions and likely predate enzymes, going back to prebiotic chemistry. However, they are considered poor organocatalysts, and thus their pre-enzymatic function remains unclear. Since metal ions are known to catalyze metabolic reactions in the absence of enzymes, here we explore the influence of metal ions on coenzyme catalysis under conditions relevant to the origin of life (20–75 °C, pH 5–7.5). Specifically, Fe or Al, the two most abundant metals in the Earth’s crust, were found to exhibit substantial cooperative effects in transamination reactions catalyzed by pyridoxal (PL), a coenzyme scaffold used by roughly 4% of all enzymes. At 75 °C and 7.5 mol % loading of PL/metal ion, Fe3+-PL was found to be 90-fold faster at catalyzing transamination than PL alone and 174-fold faster than Fe3+ alone, whereas Al3+-PL was 85-fold faster than PL alone and 38-fold faster than Al3+ alone. Under milder conditions, reactions catalyzed by Al3+-PL were >1000 times faster than those catalyzed by PL alone. Pyridoxal phosphate (PLP) exhibited similar behavior to PL. Experimental and theoretical mechanistic studies indicate that the rate-determining step in the PL-metal-catalyzed transamination is different from metal-free and biological PL-based catalysis. Metal coordination to PL lowers the pKa of the PL-metal complex by several units and slows the hydrolysis of imine intermediates by up to 259-fold. Coenzymes, specifically pyridoxal derivatives, could have exhibited useful catalytic function even before enzymes.
中文翻译:

非酶转氨基中的金属-吡哆醛协同作用
辅酶参与 ≥30% 的酶反应,并且可能早于酶,可以追溯到生命起源之前的化学。然而,它们被认为是较差的有机催化剂,因此它们的酶前功能仍不清楚。由于已知金属离子在没有酶的情况下会催化代谢反应,因此在这里我们探讨了在与生命起源相关的条件下(20–75°C,pH 5–7.5)金属离子对辅酶催化的影响。具体来说,地壳中最丰富的两种金属 Fe 或 Al,被发现在吡哆醛 (PL) 催化的转氨反应中表现出显着的协同效应,吡哆醛是一种辅酶支架,约 4% 的酶都在使用。在 75 °C 和 PL/金属离子 Fe 3+负载量为 7.5 mol % 时发现-PL 催化氨基转移的速度比单独的 PL 快 90 倍,比单独的 Fe 3+快 174 倍,而 Al 3+ -PL 比单独的 PL 快 85 倍,比 Al 3+快 38 倍独自的。在较温和的条件下,Al 3+ -PL催化的反应比单独 PL 催化的反应快 1000 倍以上。磷酸吡哆醛 (PLP) 表现出与 PL 相似的行为。实验和理论机理研究表明,PL 金属催化的氨基转移反应中的速率决定步骤不同于无金属和生物 PL 催化。金属与 PL 配位降低了p KaPL-金属配合物的数量增加了几个单位,并将亚胺中间体的水解速度减慢了 259 倍。辅酶,特别是吡哆醛衍生物,甚至可以在酶之前就表现出有用的催化功能。
更新日期:2023-06-06
中文翻译:

非酶转氨基中的金属-吡哆醛协同作用
辅酶参与 ≥30% 的酶反应,并且可能早于酶,可以追溯到生命起源之前的化学。然而,它们被认为是较差的有机催化剂,因此它们的酶前功能仍不清楚。由于已知金属离子在没有酶的情况下会催化代谢反应,因此在这里我们探讨了在与生命起源相关的条件下(20–75°C,pH 5–7.5)金属离子对辅酶催化的影响。具体来说,地壳中最丰富的两种金属 Fe 或 Al,被发现在吡哆醛 (PL) 催化的转氨反应中表现出显着的协同效应,吡哆醛是一种辅酶支架,约 4% 的酶都在使用。在 75 °C 和 PL/金属离子 Fe 3+负载量为 7.5 mol % 时发现-PL 催化氨基转移的速度比单独的 PL 快 90 倍,比单独的 Fe 3+快 174 倍,而 Al 3+ -PL 比单独的 PL 快 85 倍,比 Al 3+快 38 倍独自的。在较温和的条件下,Al 3+ -PL催化的反应比单独 PL 催化的反应快 1000 倍以上。磷酸吡哆醛 (PLP) 表现出与 PL 相似的行为。实验和理论机理研究表明,PL 金属催化的氨基转移反应中的速率决定步骤不同于无金属和生物 PL 催化。金属与 PL 配位降低了p KaPL-金属配合物的数量增加了几个单位,并将亚胺中间体的水解速度减慢了 259 倍。辅酶,特别是吡哆醛衍生物,甚至可以在酶之前就表现出有用的催化功能。

































 京公网安备 11010802027423号
京公网安备 11010802027423号