当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Competitive Activity-Based Protein Profiling Identifies Aza-β-Lactams as a Versatile Chemotype for Serine Hydrolase Inhibition
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2012-03-08 , DOI: 10.1021/ja300799t Andrea M Zuhl 1 , Justin T Mohr , Daniel A Bachovchin , Sherry Niessen , Ku-Lung Hsu , Jacob M Berlin , Maximilian Dochnahl , María P López-Alberca , Gregory C Fu , Benjamin F Cravatt
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2012-03-08 , DOI: 10.1021/ja300799t Andrea M Zuhl 1 , Justin T Mohr , Daniel A Bachovchin , Sherry Niessen , Ku-Lung Hsu , Jacob M Berlin , Maximilian Dochnahl , María P López-Alberca , Gregory C Fu , Benjamin F Cravatt
Affiliation
|
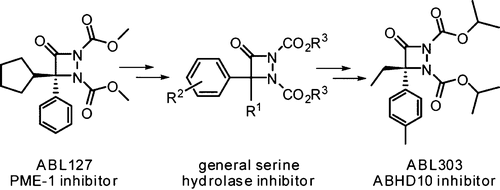
Serine hydrolases are one of the largest and most diverse enzyme classes in Nature. Most serine hydrolases lack selective inhibitors, which are valuable probes for assigning functions to these enzymes. We recently discovered a set of aza-β-lactams (ABLs) that act as potent and selective inhibitors of the mammalian serine hydrolase protein-phosphatase methylesterase-1 (PME-1). The ABLs inactivate PME-1 by covalent acylation of the enzyme's serine nucleophile, suggesting that they could offer a general scaffold for serine hydrolase inhibitor discovery. Here, we have tested this hypothesis by screening ABLs more broadly against cell and tissue proteomes by competitive activity-based protein profiling (ABPP), leading to the discovery of lead inhibitors for several serine hydrolases, including the uncharacterized enzyme α,β-hydrolase domain-containing 10 (ABHD10). ABPP-guided medicinal chemistry yielded a compound ABL303 that potently (IC(50) ≈ 30 nM) and selectively inactivated ABHD10 in vitro and in living cells. A comparison of optimized inhibitors for PME-1 and ABHD10 indicates that modest structural changes that alter steric bulk can tailor the ABL to selectively react with distinct, distantly related serine hydrolases. Our findings, taken together, designate the ABL as a versatile reactive group for creating first-in-class serine hydrolase inhibitors.
中文翻译:

基于竞争活性的蛋白质分析将氮杂-β-内酰胺鉴定为丝氨酸水解酶抑制的多功能化学型
丝氨酸水解酶是自然界中最大和最多样化的酶类之一。大多数丝氨酸水解酶缺乏选择性抑制剂,这是为这些酶分配功能的有价值的探针。我们最近发现了一组氮杂-β-内酰胺 (ABL),它们可作为哺乳动物丝氨酸水解酶蛋白-磷酸酶甲酯酶-1 (PME-1) 的有效和选择性抑制剂。ABL 通过酶的丝氨酸亲核试剂的共价酰化使 PME-1 失活,这表明它们可以为丝氨酸水解酶抑制剂的发现提供通用支架。在这里,我们通过基于竞争活性的蛋白质分析 (ABPP) 更广泛地针对细胞和组织蛋白质组筛选 ABL 来验证这一假设,从而发现了几种丝氨酸水解酶的先导抑制剂,包括未表征的酶 α、含 10 (ABHD10) 的 β-水解酶结构域。ABPP 指导的药物化学产生了一种化合物 ABL303,该化合物有效 (IC(50) ≈ 30 nM) 并在体外和活细胞中选择性灭活 ABHD10。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。
更新日期:2012-03-08
中文翻译:

基于竞争活性的蛋白质分析将氮杂-β-内酰胺鉴定为丝氨酸水解酶抑制的多功能化学型
丝氨酸水解酶是自然界中最大和最多样化的酶类之一。大多数丝氨酸水解酶缺乏选择性抑制剂,这是为这些酶分配功能的有价值的探针。我们最近发现了一组氮杂-β-内酰胺 (ABL),它们可作为哺乳动物丝氨酸水解酶蛋白-磷酸酶甲酯酶-1 (PME-1) 的有效和选择性抑制剂。ABL 通过酶的丝氨酸亲核试剂的共价酰化使 PME-1 失活,这表明它们可以为丝氨酸水解酶抑制剂的发现提供通用支架。在这里,我们通过基于竞争活性的蛋白质分析 (ABPP) 更广泛地针对细胞和组织蛋白质组筛选 ABL 来验证这一假设,从而发现了几种丝氨酸水解酶的先导抑制剂,包括未表征的酶 α、含 10 (ABHD10) 的 β-水解酶结构域。ABPP 指导的药物化学产生了一种化合物 ABL303,该化合物有效 (IC(50) ≈ 30 nM) 并在体外和活细胞中选择性灭活 ABHD10。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。PME-1 和 ABHD10 的优化抑制剂的比较表明,改变空间体积的适度结构变化可以使 ABL 选择性地与不同的、远缘相关的丝氨酸水解酶反应。综上所述,我们的发现将 ABL 指定为用于创建一流丝氨酸水解酶抑制剂的多功能反应基团。































 京公网安备 11010802027423号
京公网安备 11010802027423号