当前位置:
X-MOL 学术
›
J. Biosci. Bioeng.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
贻贝粘附蛋白的功能修饰以控制溶解度和粘附特性
Journal of Bioscience and Bioengineering ( IF 2.3 ) Pub Date : 2023-05-26 , DOI: 10.1016/j.jbiosc.2023.05.002 Anju Pilakka Veedu 1 , Kazunori Nakashima 2 , Hayahide Shiga 1 , Takahiro Sato 1 , Kasun Godigamuwa 1 , Naoki Hiroyoshi 2 , Satoru Kawasaki 2

"点击查看英文标题和摘要"
更新日期:2023-05-26
Journal of Bioscience and Bioengineering ( IF 2.3 ) Pub Date : 2023-05-26 , DOI: 10.1016/j.jbiosc.2023.05.002 Anju Pilakka Veedu 1 , Kazunori Nakashima 2 , Hayahide Shiga 1 , Takahiro Sato 1 , Kasun Godigamuwa 1 , Naoki Hiroyoshi 2 , Satoru Kawasaki 2
Affiliation
|
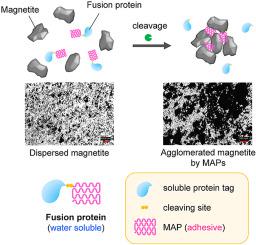
海洋贻贝产生强大的水下粘合剂,称为贻贝粘附蛋白(MAP),可以在生理条件下粘附到各种表面。因此,MAP 已被研究为传统石化粘合剂的潜在可持续替代品。重组MAP有望大规模生产和商业化;然而,MAP 本质上具有粘合性、聚集性且不溶于水。在这项研究中,我们开发了一种通过融合蛋白技术控制MAP 粘附的增溶方法。脚蛋白 1 (Fp1) 是一种 MAP,与高度水溶性的蛋白融合,该蛋白是冰核蛋白 K (InaKC) 的 C 末端结构域,由蛋白酶切割位点分隔开。该融合蛋白表现出低粘附性但高溶解性和稳定性。值得注意的是,Fp1 在通过蛋白酶切割从 InaKC 部分去除后恢复了其粘附性能,这一点通过磁铁矿颗粒在水中的团聚进行了评估和证实。控制粘附和团聚的能力使 MAP 作为生物基粘合剂具有良好的前景。

"点击查看英文标题和摘要"
















































 京公网安备 11010802027423号
京公网安备 11010802027423号